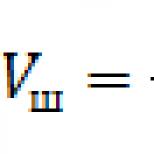Законът на Бойл-Мариот. Газови закони Изотерма. Законът на Дихани Бойл - Формулировка на закона на Мариот Бойл на Мариот Ризне
Нека сега преминем към докладваната промяна в храненето, тъй като налягането на течната маса върху газа се променя, тъй като температурата му става непроменлива и се променя, без да се консумира от газа. Вече знаехме защо това изотермиченПроцесът се извършва, за да се гарантира, че температурата на тялото остава постоянна, така че газът да може да излезе, а газовият поток се променя постоянно, така че температурата на газа по време на процеса да не се променя с температурата на излишното тяло. Представяме този ред на хранене: как налягането и налягането са свързани помежду си по време на изотермична промяна? Добра новина е да имате предвид, че когато подаването на течност към газа се промени, неговото налягане се увеличава. Като дупе можете да посочите еластичността при надуване на футболна топка, велосипед или автомобилна гума. Захранването спира: как се увеличава налягането върху газа, когато захранването се промени, когато температурата на газа остане непроменена?
Това хранене е потвърдено от изследвания, разработени през 17 век от английския физик и химик Робърт Бойл (1627-1691) и френския физик Едем Мариот (1620-1684).
След като инсталирате празнината между обема и налягането на газа, можете да направите това: на вертикална стойка , изпечен наполовина, има стъклена тръбичка Аі IN,свързани с хумна тръба C. Тръбата е пълна с живак. Тръбата е отворена и има кран на тръба А. Нека затворим този кран, като по този начин затворим потока вода близо до тръбата А.Въпреки че не премахваме тръбите, количеството живак и в двете тръби остава същото. Това означава, че налягането на вятъра е затворено в тръбата а,точно като налягането на твърде силен вятър.
Сега можем напълно да вдигнем телефона U. Вярваме, че живакът в двете тръби се повишава, но не и в тръбата UЖивачният ревен ще бъде по-висок през цялото време, по-нисък при А. Ако намалите тръба B, тогава живачният ревен в двете колони ще намалее, но в тръбата Uнамалявам повече, по-ниско А.Обем на въздуха, затворен в тръбата а,може да се държи зад тръбите А.Налягането на този въздух се издига от атмосферното налягане със стойността на налягането на живака, чиято височина е текущата разлика в нивата на живака в тръби A и B. Когато. Вдигнете слушалката UНалягането на живака се добавя към атмосферното налягане. Обемът на въздуха в А се променя. Когато тръбата е спусната Uнивото на живака в него изглежда по-ниско, отколкото в А, и налягането на живака се повишава от атмосферното налягане; обем на въздуха в А
Със сигурност ще се увеличи. По този начин стойността на налягането и обемът на тръбата, затворена в тръбата А, се обръщат, така че при увеличен обем на масата налягането на същата се променя няколко пъти, И то случайно. Температурата на въздуха в тръбата може да се поддържа постоянна за нашите наблюдения. Подобни резултати могат да се получат и с други газове. Резултатите са същите. Отже,
Налягането на течна маса върху газ при постоянна температура е пропорционално на потока газ (закон на Бойл-Мариот).За разредените газове законът на Бойл-Мариот достига високо ниво
точност. За газове, които са силно компресирани или охладени, има значителни разлики в съответствие с този закон. Формулата, която изразява закона на Бойл-Мариот.
Изследванията на великия английски учен Бойл раждат хората на новата химическа наука. Той разглежда химията като самостоятелна наука и показва, че тя има свои проблеми, свои задачи, които изискват да бъдат решени със свои методи, различни от медицината. Систематизирайки числовите цветни реакции и реакциите на утаяване, Бойл постави началото на аналитичната химия. Той става автор на един от първите закони на физико-химическата наука, който се популяризира.
Робърт Бойл (1627-1691) е тринадесетото дете от четиринадесетте деца на Ричард Бойл, първият херцог на Корк, яростен и успешен любител на богатството, който е жив по времето на кралица Елизабет и е умножил успеха си в ограбването на чуждестранни земи. Той е роден в замъка Лесмор, един от ирландските бащи. Робърт прекарва детството си там. След като постигнах чудеса у дома, станах студент в Итънския университет след осемгодишна възраст. Там той преживя четири съдби, след което баща му Столбридж отиде при новите дънни платки.
Както беше обичайно по това време, на дванадесетгодишна възраст Робърт и брат му бяха изпратени по пътищата на Европа. Ще решите да продължите обучението си в Швейцария и Италия и сте прекарали шест години там. Бойл се завръща в Англия едва през 1644 г., след смъртта на баща си, който го лишава от значителната му позиция.
Столбридж отговаря за лабораторията, където до края на 1645 г. провежда изследвания по физика, химия и селскостопанска химия. Бойл обичаше да се справя с толкова много проблеми наведнъж. Обадете се за отчет, обяснете на асистентите какво ще трябва да работите за деня и след това отидете в офиса, където секретарят го проверява. Там той диктува своите философски трактати.
Учен енциклопедист, Бойл се занимава с проблеми на биологията, медицината, физиката и химията, като проявява не по-малък интерес към философията, теологията и науката. Бойл придава голямо значение на лабораторните изследвания. Най-полезните и разнообразни продукти бяха резултатите от химията. Оценяваме, че химията, след като се слее с алхимията и медицината, може да стане самостоятелна наука.
От самото начало Бойл започва да извлича инфузии от цветя, билки, лишеи, дървесна кора и коренни плевели. Най-забележима беше виолетовата инфузия, извлечена от лакмусов лишей. Киселините промениха цвета си в червено, а ливадите в синьо. Бойл нареди хартията да се накисне в тази инфузия и след това да се изсуши. Един тефтер от такава хартия, уморен да пробва вината, да си сменя цвета и да показва колко са кисели вината и колко са кисели. Това е една от първите речи, които Бойл също нарича индикатори.
Внимателните учения бяха последвани от все по-голяма сила на властите: ако преди рязане на дървото в азотна киселина се добави малко солна киселина, се образува бяла утайка, която Бойл нарече „месецът на роговицата“ (дървесен хлорид ). Тъй като тази обсада бяха лишени от открития кораб, Чернивите. Имаше аналитична реакция, която достоверно показва, че следващата реч съдържа „месец“ (среебло).
Младите хора се съмняват в универсалната аналитична валидност на огъня и други методи за анализ. Многобройни проучвания показват, че ако речта е изложена на тези или други реактиви, вонята може да се разпространи до най-простите сетива. Могат да бъдат посочени Vikoristic и специфични реакции. Някои хора създават ферментирали отпадъци, други виждат газ с характерна миризма, а трети дават ферментирали отпадъци. Бойл нарича процеса на разграждане и идентифициране на екскретираните продукти чрез анализ на допълнителни характерни реакции. Това е нов метод на работа, който даде на пощенските служители развитието на аналитичната химия.
През 1654 г. се премества в Оксфорд, където продължава експериментите си със своя асистент Вилхелм Гомберг. Разследванията бяха сведени до една цел: да се систематизират изказванията и да се разделят на групи според авторитета им.
След Хомберг негов асистент става младият физик Робърт Хук. Те посветиха своите изследвания главно на газовете и развитието на корпускулярната теория.
Научавайки от научни публикации за работата на немския физик Ото Герике, Бойл решава да повтори своя експеримент и по същата причина да използва оригиналния дизайн на вятърната помпа. Първият поглед върху тази машина беше постигнат с помощта на Хук. Разследващите успели да отстранят напълно водата с помпа. Всички опити да се осигури наличието на етер в празен съд станаха неприятни.
„Жадният етер не пресъхва“, каза Бойл, след като приключи изследването си. Празното пространство във вените обикновено се нарича вакуум, което на латински означава „празно“.
През 1660 г. Бойл изпълнява първата си задача към великия научен робот - "Нови физико-механични експерименти, ако се върнете и го покажете." Книгата "Химик - скептик" се превърна в пробив. В тези книги Бойл не оставя камък необърнат относно оценката на Аристотел за многото елементи, които той открива
две хиляди скали, картезиански „етер“ и три алхимични почви. Естествено този процес предизвиква остри нападки от последователите на Аристотел и картезианците. Протестът Бойл се криеше от някой друг и доказателствата му бяха неопровержими. Повечето учени - последователи на корпускулярната теория - възприеха идеите на Бойл от съкровища. Много от неговите идеологически противници също бяха объркани от разкритието.
Новият асистент в оксфордската му лаборатория е младият физик Ричард Таунли. В същото време Бойл открива един от основните физични закони, установявайки, че промяната в газовия поток е пропорционална на промяната в налягането. Това означаваше, че знаейки промяната в задълженията на съдията, беше възможно точно да се определи промяната в налягането на газа. Това се превърна в най-голямото разкритие на 17 век. Бойл го описва за първи път през 1662 г. („За защита на еластичността на вятъра“) и скромно го нарича хипотеза.
Концепцията за напрежението на пружината, която съответства на новата концепция за порока, е основна в идеите на по-късните изследвания на Бойл.
„Еластичността на вятъра“, пише Лиози, „е демонстрирана от Паскал преди теста, повторен от Академията за изследване и Херица. Крушката ще се раздуе от вятъра, ако я поставите в барометрична камера или в резервоар, от който се изпомпва вятърът. Доказателствата от Герике за двата съда, които той получи, също свидетелстват за силата на вятъра. Важно е да се отбележи, че от описанията на изследването възниква теорията за еластичността. Този термин, въведен от Пеке през 1651 г., е широко възприет от Бойл, който също прави първите изследвания на еластичността на твърдите тела.
Франческо Лино (1595-1675), който по същество стоеше зад идеите, представени от Фабри, както и Мерсен, който искаше да припише ефекта на Торичели и овлажняването на водата с помпа, отделяща „смучещите“ частици вода, се зае оръжия срещу подобно разсъждение.И отново се слепват един след друг. В своя труд „За експеримент с живак в стъклени тръби...“, публикуван през 1660 г., Лено обяснява как да спуснете тръба в живак, да отворите двата края и след това да покриете горния край с пръст и често Как да издърпате тръба от живак, тогава можете да почувствате възглавничката на пръста си, изтеглена в средата на тръбата. Ts Zerinnya, Mirku, Dali Líno, не за наричането на атмосферна виска, а за вътрешната сила, богай от невидими нишки („фънки“) майчински хора, с бияч с един кинец и с роза на устата.
В същото време подобни идеи ви карат да се усмихвате, но те също изискват сериозно обмисляне, след като сте се поучили от Бойл в работата си „Защитата срещу Лено“ и си поставихте за цел да осъзнаете, че еластичността ще бъде създадена отново в повече, по-малко просто , сутрини. "Маната на Торичели."
Бойл описва незабравимо своето изследване: „Взехме дълга чаша от тръбата, тъй като с ръка на майстор зад нея лампата беше огъната по такъв начин, че огънатата част на лампата беше почти успоредна на устата. Отворът на този къс... беше херметически затворен. Късото коляно през целия си живот е разделено на инчове (кожата на всеки дял върху цялата част) с помощта на хартия с апликирана хартия, която е внимателно залепена към тръбата. Тази много хартиена хартия беше залепена на дълъг връх. След това тръбата се напълва с „живак в такъв обем, че да запълни кръглата или извитата част на сифона“ и стои на едно ниво в двете колони. „След като беше смачкана, започнахме да добавяме живак към другата тръба... докато краят на късата тръба не показа, че налягането се е променило толкова много, че е заело само половината от първоначалния обем... Не го направихме не отвръщаме очи от предишната тръба... „Забелязахме, че живакът в този край на тръбата е с 29 инча по-висок, отколкото в другия.“
Добавяйки подкрепа към тези експерименти, Бойл отбелязва: „Когато масата беше притисната една към друга във въздуха, тя се сгъсти в обем, който съставлява една четвърт от кочан, ние опитахме колко студена беше с ленена кърпа, напоена с вода, Вятърът се усилва. И за един час изглеждаше, че става прекалено стегнато, така че нямаше подова настилка, върху която да се работи с каквито и да е крепежни елементи. След това опитахме и топлината... разширяване на въздуха; Когато половината от свещта беше близо до тази част, където беше поставена на вятъра, се оказа, че топлината се усеща повече от студа.
Цикаво, че не Бойл, а Таунли е получил доказателствата от разследването. Бойл посочва, че Ричард Таунли, прочитайки първата си работа „Нови физико-механични експерименти върху пружини“, е измислил хипотезата, че „натискът и издърпването са пропорционални едно на друго“.
Я.Г. Дорфман пише: „Петнадесет години след публикуването на тези изследвания от Бойл, а след това през 1679 г., Франция получава „Мъж за природата на вятъра“ от абат Едма Мариот, в който ред подобни експерти описват други диети. Според думите на Бойл, резултат от дълъг период от време между натиска на вятъра и нека се заемем. Мариот не казва нито дума за своя наследник, въпреки че работата на Бойл с пневматиката е напълно неизвестна. По това време работата на Бойл беше широко видима: вонята беше публикувана на латински и английски език. В същото време Мариот не забрави да отгатне своя наследник, дори и през 1673 г., когато говори за брака на вината, без да каже нито дума за работата на Хюйгенс, поставяйки не само експерименталния метод, но и основата на теорията.
Работата на Мариот значително жертва работата на Бойл в името на усърдието за експеримента. Бойл, както научихме, изчислява височината на живачната смес с точност до шестнадесети от инча, което прави човек наистина внимателен към стойностите на изчисленията и предупреждава за предстоящата кражба на вимирите. Marriott показва височината на живака в цели инчове и заявява, че последните данни са в строго съответствие с мащаба. Внимателен и критичен, Бойл нарича създадения от него закон само „хипотеза“, която изисква експериментално потвърждение. Marriott го нарича закон и правило на природата. Така че, честно казано, „законът на Бойл-Мариот“ може да се нарече „закон на Бойл-Таунли“ или „Бойл-Таунли-Хук“. За съжаление, понякога в курсовете по физика Милково става твърдо установено, но Мариот „изясни“ изследването на Бойл, което не демонстрира валидност.“
Prote Marriott (1620-1684) прехвърля клането на закона. Сред тях най-важното е да се определи височината на мястото въз основа на данните от барометъра. Разрахунок, който се извършва по начина на работа с безкрайно малки количества, като се позовава на печалния резултат от слабата математическа подготовка от миналото.
По-късно през 1686 г. английският астроном Едмънд Халей (1656 - 1742) осъзнава проблема с изчисляването на атмосферната височина. Повечето читатели знаят, че под неговото име има комета. Така че оста, Халей знае, че формулата по същество е правилна, тъй като не променя температурата. Същността на формулата на Халей се свежда до твърдението, че с увеличаване на височината в аритметична прогресия атмосферното налягане се променя в геометрична прогресия.
Yak mi dikhaemo?
Обемът на въздуха между луковиците на краката и външната сърцевина се променя в резултат на ритмични дихателни движения на гръдния кош. При вдишване обемът на гръдния кош и крака се увеличава, при което натискът върху тях намалява и тече през дихателните пътища (нос, гърло), за да влезе в луковицата на крака. Когато обемът на гръдната стена се промени, налягането върху гръдните луковици се премества и излишъкът от въглероден оксид (въглероден диоксид) излиза от гръдните луковици. Тук влиза в действие законът на Бойл-Мариот, така че съхранението е под натиск.
Колко време не можем да умрем? Дори тренираните хора могат да стегнат дъха си за 3-4 и за 6 минути, но не повече. Нещо повече, киселото гладуване може да доведе до смърт. Ето защо кисенът навлиза в тялото постепенно. Dihannia е прехвърлянето на киселото от тялото към останалата част от тялото.Основен орган на дихотомичната система
- Бели дробове, включително плевралната област.
Въз основа на закона на Бойл-Мариот
Газовите закони се практикуват активно в технологиите и в живата природа и се използват широко в медицината.
Законът на Бойл-Мариот започва да се „прилага за хората“ (както и за всички хора) от момента на тяхната националност, от първата независима смърт.
При облекчаване на междуребрения мускул диафрагмата периодично променя обема на гръдния кош. Ако гръдната стена се разшири, тогава налягането на вятъра в краката пада по-ниско от атмосферата. “изисква” изотермичния закон (pv=const), а в резултат на спада на налягането, което след като се утаи, се издишва.
Dikhannya legeneve: дифузия на газове в legenes
За да бъде ефективен обменът на дифузионния път, обменната повърхност трябва да е голяма, а дифузионната повърхност трябва да е малка. Дифузионната бар'ера в краката е напълно съгласна с тези умове. Повърхността на алвеолите трябва да бъде приблизително 50 - 80 квадратни метра. м. Поради структурните си характеристики тъканта на крака е подходяща за творческа дифузия: покривните капиляри са подсилени в алвеоларното пространство с най-тънката топка от плат. По време на процеса на дифузия киселинността преминава през алвеоларния епител, интерстициалното пространство между главните мембрани, капилярния ендотел, кръвната плазма, еритроцитната мембрана и вътрешното ядро на еритроцита. Общата дифузна стойност става приблизително 1 микрон.
Молекулите на въглеродния диоксид дифундират по този път и директно от еритроцита към алвеоларното пространство. Въпреки това, дифузията на въглероден диоксид става възможна само след освобождаването на неговото химическо свързване от други съединения.
Когато червените кръвни клетки преминават през капилярите на крака, продължителността на възможната дифузия (час на контакт) е очевидно малка (около 0,3 s). Този час обаче е напълно достатъчен налягането на дихателните газове в кръвта и парциалното налягане в алвеолите практически да се изравнят.
Важно е да се изчисли дихателният обем и жизненият капацитет на крака.
Предназначение:означава дихателния обем и жизнения капацитет на крака.
Обладнання:Чантата е усукана, шевът е избелял.
Скриване на роботи :
Чантата е надута максимално за N (2) спокойни гледки.
Измерваме диаметъра на торбата и нейния разширяем обем по формулата:
De d е диаметърът на кули.
Броят на видовете може да се изчисли: , където N е броят на видовете.
Възможно е чантата да е още две и средната стойност на физическия обем на краката й да е изчислима
![]()
![]()
![]()
Значителният жизнен капацитет (VC) е най-големият обем въздух, който човек може да изпита след дълбоко вдишване. За това, без да вдигате торбата от устата си, поемете дълбоко въздух през носа си и поемете дълбоко въздух през устата през торбата. Да повторим 2 пъти. de N=2.
Робърт Бойл и директно преведен от Едмус Мариот през 1676 г. Описва поведението на газа в изотермичен процес. Според съвременната физика законът е наследство от Клапейрон – Менделев.Формула
Спазването на закона Бойл-Мариот е в сила:
В математическа форма твърдението е написано под формата на формула
p V = C , (\displaystyle pV = C,)де p (\displaystyle p)- Натиснете газта; V (\displaystyle V)- натиснете газта и C (\displaystyle C)- Величината е постоянна в умовете на умовете. За значението на zagal vipadku C (\displaystyle C)се указва от неговата химическа природа, маса и температура на газа.
Очевидно какъв е индексът 1 стойност на стойностите, които лежат преди газа, и индекса 2 - До края, след което дадената формула може да бъде записана във формата
p 1 V 1 = p 2 V 2 (\displaystyle p_(1)V_(1)=p_(2)V_(2)).От казаното и от дадените формули виждаме налягането на газа при изотермичен процес:
p = CV. (\displaystyle p=(\frac (C)(V)).)Това съхранение е различно, еквивалентно на първото, вместо закона на Бойл-Мариот. Won означава това
Налягането на дадена маса газ, която е с постоянна температура, е пропорционална на нейния обем.
Връзката между крайните и крайните газове, които участват в изотермичния процес, може да се изрази по следния начин:
p 1 p 2 = V 2 V 1 . (\displaystyle (\frac (p_(1))(p_(2)))=(\frac (V_(2))(V_(1))).)Трябва да се отбележи, че стагнацията на цената и индуцираната формула, която свързва колелото и крайните порокове и газовите обеми един по един, не е ограничена от появата на изотермични процеси. Формулите вече не са валидни, ако температурата се промени по време на процеса, но в резултат на процеса крайната температура е равна на крайната температура.
Важно е да се изясни, че този закон е валиден само в тези ситуации, когато този газ може да се счита за идеален. Ето защо, с висока точност, законът на Бойл-Мариот определя сто разредени газове. Ако газът е много силен, тогава трябва да се внимава да не се спазва този закон.
Наследство
Законът на Бойл-Мариот твърди, че налягането върху газа в изотермичен процес е пропорционално на заетия газ. След като осъзнаем, че дебелината на газа също е пропорционална на обема, който заема виното, тогава ще стигнем до заключението:
β T = 1 p. (\displaystyle \beta _(T)=(\frac (1)(p)).)По време на изотермичен процес налягането върху газа се променя право пропорционално на неговата дебелина.
По този начин стигаме до върха:
Изотермичният коефициент на течливост на идеален газ е равен на стойността на въртене на неговото менгеме.
див. също
Бележки
- Петрушевски Ф. Ф.// Енциклопедичен речник на Брокхаус и Ефрон: в 86 тома (82 тома и 4 допълнения). - Санкт Петербург. , 1890-1907.
Разликата между параметрите, които характеризират процеса на дадена маса газ, става ясно от промяната на газовите процеси, които се извършват поради инвариантността на един от параметрите. Четене на английски Бойл(1669 рубли) и френска версия Мариот(1676 г.) въвежда закон, който изразява значението на промяната на налягането преди промяна на подаването на газ при постоянна температура. Ще проведем офанзивно разследване.
Обвивките на дръжката са променливо покрити с газ (повтарящо се) в цилиндър А (фиг. 11, а). Обърнете внимание на показанията на манометъра и промените в налягането на газа. Променете налягането на газа в съда (температурата е посочена на скала B) и като отбележите налягането, запишете ги в таблицата. 1. От него става ясно, че подаването на газ за това налягане е много по-постоянно: колкото пъти се е променило подаването на газ, толкова пъти се е увеличило налягането.

В резултат на подобни, по-точни изследвания беше открито: за дадена маса газ при постоянна температура налягането върху газа се променя пропорционално на промяната в налягането върху газа. Това е формулировката на закона на Бойл-Мариот. Математически стойността за два етапа може да бъде записана по следния начин:
![]()
Процесът на промяна на газта до постоянна температура се нарича изотермичен.Формулата за закона на Бойл-Мариот е равна на изотермичното състояние на газа. При постоянна температура средната течливост на молекулите не се променя. Промяната в подаването на газ води до промяна в броя на ударите на молекулите върху стените на съда. Това е причината за промяна на налягането на газта.
Този процес може да си представите графично, например, за всеки случай V = 12 l, p = 1 at.. Обемът на газа е показан на абсцисната ос, а обемът на газа е показан на ординатната ос (фиг. 11, b). Ние знаем точките, които показват стойността на V и p за двойката кожа и, като ги свържем една с друга, можем да начертаем графика на изотермичния процес. Линия, която представлява пространството между обема и налягането на газа. При постоянна температура се нарича изотерма. В чиста форма изотермичните процеси не се ускоряват. Има чести повреди, когато температурата на газа се променя малко, например, когато въздухът се изпомпва в цилиндрите от компресор, когато горивната смес се въвежда в цилиндъра на двигателя с вътрешно горене. При такива епизоди на дегенерация натискът върху газа трябва да се извършва в съответствие със закона на Бойл-Мариот*.