От които зависи степента на ензимна реакция. Какво зависи от ензимната активност? Структурата на ядрото. Изотопи
Въведение
Една от характерните прояви на живота е способността на живите организми да регулират кинетично химическите реакции, потискането на желанието за постигане на термодинамично равновесие. Ензимната кинетика е ангажирана в изследването на законите на влиянието на химичното естество на реакционните вещества (ензими, субстрати) и условията на тяхното взаимодействие (концентрацията, рН на средата, температурата, присъствието на активатори или инхибитори ) до скоростта на ензимна реакция. Основната цел на изучаването на кинетиката на ензимните реакции е да се получи информация, която може да допринесе за изясняване на молекулярния механизъм на ензимното действие.
Зависимостта на скоростта на ензимна реакция от концентрацията на субстрата
ензимен субстрат биохимичен инхибитор
Общи принципи на кинетиката на химичните реакции са приложими към ензимните реакции. Известно е, че всяка химична реакция се характеризира с константа на термодинамичното равновесие. Той изразява състоянието на химичното равновесие, постигнато от системата и е посочено от Република Киргизстан. Така че, за реакция:
равновесната константа е равна на продукта на концентрациите на оформените вещества, разделени на продукта на концентрацията на изходните вещества. Стойността на равновесното константа обикновено се намира от съотношението на константи на скоростта (K + 1) и обратни (K - 1) реакции, т.е.
В състояние на равновесие, скоростта на директната реакция:
v + 1 \u003d k + 1 [a] * [b]
равен на скоростта на обратната реакция:
v-1 \u003d k-1 [s] [d],
тези. V + 1 \u003d V-1
съответно k + 1 [a] * [b] \u003d k-1 [s] * [d],

Фиг. един.
реакции от концентрацията на субстрата при постоянна концентрация
ензим
а - реакция на първа поръчка (когато [s]<Кm скорость реакции пропорциональна концентрации субстрата); б - реакция смешанного порядка; в - реакция нулевого порядка, когда v = Vmaxi скорость реакции не зависит от концентрации субстрата.
По този начин равновесният константа е равен на съотношението на постоянните скорости на преки и обратни реакции. Стойността, обратната равновесна константа, е обичайна за повикване на основата на субстрата, или, в случай на ензимен отговор, комплекс за дисоциация постоянен ензим-субстрат и обозначаване на символа KS. Така, в реакцията
тези. КС е равна на съотношението на продукта на концентрацията на ензима и субстрата до концентрацията на ензим-субстратния комплекс или съотношението на постоянната скорост и директните реакции. Трябва да се отбележи, че константата на КС зависи от химическата природа на субстрата и ензима и определя степента на техния афинитет. Колкото по-ниско е стойността на KS, толкова по-висока е афинитетът на ензима към субстрата.
При изучаване на кинетиката на ензимните реакции трябва да се вземе предвид една важна характеристика на тези реакции (не е присъща на конвенционалните химични реакции), свързани с явлението на насищане на ензимния субстрат. При ниска концентрация на субстрата, зависимостта на скоростта на реакцията от концентрацията на субстрата (фиг. 1) е почти линейна и се подчинява на кинетиката на първия ред. Това означава, че скоростта на реакцията S-\u003e P е пряко пропорционална на концентрацията на субстрата S и по всяко време t се определя от следното кинетично уравнение:
където [s] е моларната концентрация на субстрата S; -d [s] / dt - скоростта на загуба на субстрата; K "- постоянна скорост на реакция, която в този случай има измерение, обратна единица от време (min-1 или С-1).
При висока концентрация на субстрата скоростта на реакцията е максимална, става постоянна и независима от концентрацията на субстрата. В този случай реакцията е обект на кинетика с нулев ред v \u003d k "(с пълна насищане на ензима с субстрат) и се определя изцяло от концентрацията на ензима. Те се различават освен това, реакцията на втория ред , чиято скорост е пропорционална на продукта на концентрациите на два реагенти. при определени условия, пропорционалността е посочена. Понякога има реакции на смесени поръчки (виж фиг. 1).
Проучване на феномена на насищане, L. Michaelis и M.NENEN разработиха обща теория на ензимната кинетика. Те пристъпиха от предположението, че ензимният процес продължава под формата на следната химична реакция:
тези. Ензимът влиза в взаимодействието със субстрата S, за да образува междинен комплекс ES, който допълнително се разпада в свободен ензим и реакционния продукт R. Математическа обработка, основана на закона на активните маси, дава възможност да се извлече уравнението, призовано в чест на Авторите от уравнението на Michaelis-Menten, изразяват количествената връзка между концентрацията на субстрата и скоростта на ензимната реакция:
където V е наблюдаваната реакционна скорост при тази концентрация на субстрата [s]; KS постоянен комплекс на ензима-субстрат, mol / l; Vmax е максималната скорост на реакцията с пълната насищане на ензимния субстрат.
От уравнението на Michaelis-Menten следва, че с висока концентрация на субстрата и ниската стойност на КС скоростта на реакцията е максимална, т.е. V \u003d vmax (реакция на нула, виж фиг. 1). При ниска концентрация на субстрата, напротив, скоростта на реакцията се оказва пропорционална на концентрацията на субстрата при всеки даден момент (реакция от първи ред). Трябва да се посочи, че уравнението на Michaelis-Menten в нейната класическа форма не отчита ефекта върху скоростта на ензимния процес на реакционните продукти, например в реакцията
и носи донякъде ограничен характер. Ето защо бяха направени опити за подобряване. Така беше предложено уравнението на Briggs-задържането:
където km е константа на Michaelis, която се определя експериментално от стойността. Тя може да бъде представена от следното уравнение:

Фиг. 2. - Уравнение на Mikhailisa-Mentnene: Hyperbolic
зависимостта на първоначалните скорости, катализирани от реакционния ензим
от концентрацията на субстрата
Дистрибуторните константи на скоростта на разпадане на комплекса ES са представени в две посоки (към началния E и S и в посока на крайните реакционни продукти E и P). Съотношението K-1 / K + 1 е константа на дисоциация на ензим-субстратния комплекс KS, след това:
Това предполага важна последица: константата на Mikhaelis винаги е по-голяма от константата на дисоциацията на комплекса на ензима-субстрат КС чрез стойността на К + 2 / К + 1.
За да се определи числената стойност на км, обикновено се намира концентрацията на субстрата, при която скоростта на ензимна реакция V е половината от максималната Vmax, т.е. Ако v \u003d 1/2 vmax. Заместване на стойността на V към уравнението на Briggsa-Handane, ние получаваме:
споделяме двете части на уравнението на VMA, ние получаваме
По този начин, константата на михаелите е числено равна на концентрацията на субстрата (mol / l), в която скоростта на тази ензимна реакция е половината от максимума.
Дефиницията на стойността на KM е важна, когато механизмът на действие на ефектори на активността на ензимите и др. Mikhaelis константа може да бъде изчислена по график (фиг. 2). Намаляване на абсцисата, съответната скорост, равна на половината максимума, ще бъде km.
За да се използва графика, конструирана в директни координати на зависимостта на първоначалната скорост на реакцията V0 от първоначалната концентрация на субстрата е неудобна, тъй като максималната скорост Vmax е в този случай асимптотична стойност и не е дефинирана точно.

Фиг. 3.
За по-удобно графично представяне на експерименталните данни на град Линувър и Д. Бек трансформира уравнението Briggsa-Handane в съответствие с метода на двойните връщащи стойности въз основа на принципа, че ако има равенство между две всякакви стойности, тогава Обратните стойности също ще бъдат равни. По-специално, ако
след това след трансформацията получаваме уравнението:
които са получили името на уравнението на Linuiver-бара. Това уравнение е права линия:
Ако, в съответствие с това уравнение, изградете графика в координатите 1 / v (Y) от l / [s] (x), след това получаваме права линия (фиг. 3), танкелето на ъгъла на наклона, който ще бъде да бъдат равни на стойността на km / vmax; Сегмент, който отряза направо от ордена ос е l / vmax (обратна максимална скорост).
Ако продължите линията за ордена ос, абсцисата намалява сегмента, съответстващ на обратната величина на трасето на Михаелис - 1 / km (виж фиг. 3). По този начин стойността на KM може да бъде изчислена от наклона на данни и дължината на сегмента, изрязана от ординатната ос, или от дължината на сегмента, отрязани от оста на абсциса в областта на отрицателните стойности.
Трябва да се подчертае, че стойностите на VMAX, както и стойността на км, по-точно, както в графика, вградени в директни координати, могат да бъдат определени в съответствие с графика, изграден в съответствие с метода на двойно обратни стойности. Следователно този метод е широко използван в съвременната ензимология. Подобни графични методи за определяне на km и vmax в координатите на V / v / [s] и [s] / v от [s] също са предложени.
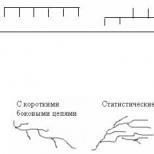
Трябва да се отбележат някои ограничения за използването на уравнението на Michaelis-Menthenenes, поради множество форми на ензими и алто-природата на ензима. В този случай графиката на зависимостта на първоначалната скорост на реакцията от концентрацията на субстрата (кинетична

Фиг. четири.
кривата) не е хиперболична форма, а сигмоиден знак (фиг. 4) като крива на насищане с кислород в Bemoglobin. Това означава, че свързването на една субстратна молекула в един каталитичен център увеличава свързването на субстрата с друг център, т.е. Има кооперативно взаимодействие, както в случай на прикрепване на кислород до 4 субединици на хемоглобина. За да се оцени концентрацията на субстрата, в която скоростта на реакцията е наполовина максималната, в сигмоидната природа на кинетична крива обикновено използвайте уравнението на конвертируемия хълм:
където k "- константата на сдружението; n е броят на субстрата на свързващите центрове.
Скоростта на ензимните реакции зависи от концентрацията на под-
стратум. Тази зависимост е сложна, която за някои ензими се описва с параболична крива (фиг. 29).
Фигура 29 - зависимостта на скоростта на ензимната реакция
от концентрацията на субстрата
Парабощият характер на зависимостта се обяснява с факта, че когато ензимът взаимодейства с субстрата, е ензим-субстратният комплекс. Първоначално с повишаване на концентрацията на субстрата, увеличаване на концентрацията на ензимни субстратни комплекси в реакционната смес, която се проявява в паралелно увеличение на скоростта на реакцията. При определена концентрация на субстрата (насищане) се наблюдава особена "насищане" на всички активни центрове на ензимни молекули в реакционната смес. Скоростта на ензимната реакция при наситена концентрация става максимална. При допълнително увеличаване на съдържанието на субстрата в реакционната смес тя не се променя.
От графиката на зависимостта на скоростта на ензимна реакция от концентрацията на субстрата се изчисляват два важни индикатора:
1. Максимална скорост на реакция (В. Max). Той се дефинира като скорост на реакцията при наситена концентрация на субстрат. Стойността на максималната скорост отразява каталитичната мощност на ензима. Ензими с по-голяма величина В. Макс, са по-мощни катализатори. В единица време те катализират трансформацията на повече молекули на субстрат. Мащабът на максималната скорост се изразява чрез броя на ензимната скорост. Броят на оборотите се оценява от количеството на молекулите на субстрата, преобразувани от ензима за единица време (С-1). За повечето ензими броят на оборотите е в рамките на 10 4. В същото време има ензими за които скорост Значително повече (600000 - за карбантидаза) или по-малко от тази стойност (100 - за химотрипсин).
2. Постоянна Михаилеса (ДА СЕ м). Константата на Mikhailis е концентрация на субстрат, при която скоростта на реакцията е половината максимума. Стойност ДА СЕ M отразява афинитета на ензима към подпродава. Колкото повече тази стойност е, толкова по-малко афинитет към субстрата има ензим. ДА СЕ M се експресира в основите на субстрата. Така че, сумата ДА СЕ M По отношение на глюкозата в ензимния глюкоцинат е 10 mmol, и за хексохинази - 0.01 mmol. Hexocinase проявява повече афинитет за глюкоза от глюкоцинат, със същата концентрация на субстрата, той катализира фосфорилирането на глюкоза с по-голяма скорост.
Въз основа на математическия анализ на кривата на зависимостта на скоростта на ензимната реакция от концентрацията на субстрат L. michaelis и mm mentenes (1913) е получена формула, което позволява да се оцени връзката между отговора скоростта, максималната скорост и константа на Майкъл. Понастоящем тя се определя като уравнението на Michaelis - Menten.
В. o \u003d. В. Макс С.]/К. M + [ С.],
където В. o - скорост на реакция, С. - концентрация на субстрат.
Общи свойства на ензимите
Въпреки наличието на някои разлики в структурата, функциите и вътреклетъчната локализация, редица общи свойства се характеризират с ензими. Те включват зависимостта на проявата на тяхната каталитична активност при температура (термируемост) и рН на средата, както и специфичност на субстрата.
Характерното свойство на ензимите е термоличност. Това явление може да бъде илюстрирано чрез графика на зависимостта на скоростта на ензимната реакция при температурата на реакционната смес (фиг. 30).

Фигура 30 - зависимост на скоростта на ензимна реакция при температура
реакционна среда ( t. Температура на едро - оптимална температура; В.- реакция на скоростта)
Както може да се види от графиката, представена при температура близо до 4 o с ензимни реакции, почти не вървят. Поради тази причина биологичните обекти могат да се съхраняват в определено време, преди да извършват биохимични изследвания в студа. Това е студът, който ви позволява да поддържате хранителни продукти от автолиза (самозагасяващ се).
Увеличаването на температурата се придружава от увеличаване на скоростта на ензимна реакция. Причината за това е увеличаването на кинетичната енергия на молекулите на субстрата и ензима, което допринася за увеличаване на процента на взаимодействие между тях. Подобен феномен се наблюдава при температура, която съответства на оптималния ензим на температурата. Температурен оптимален ензим съответства на температурата, при която скоростта на ензимна реакция е максимална. За ензимите на топлокръвни животни обикновено е 28 ° С или 37 ° С.
По-нататъшното увеличаване на температурата на реакционната смес води до постепенно намаляване на скоростта на ензимна реакция. Това явление се дължи на процеса на термично моделиране на протеин полипептидната верига. Денатурирането е придружено от промяна в структурата на активния център на ензима, следствие от това, че афинитетът на ензима засяга подраздема става. При температури над 55 о, повечето ензими напълно губят каталитичните свойства (инактивирани). В това отношение, затоплянето до 55-56 o C е широко използвано за процедурата по пастьоризация, което увеличава срока на годност на храната (мляко и т.н.).
Голямо влияние върху скоростта на ензимната реакция има рН на средата. Както може да се види от представената на фиг. 31 графики, напомня формата на графика на зависимостта на скоростта на ензимна реакция при температура.

Фигура 31 - Зависимост на скоростта ( В.) Ензимна реакция
от рН средата (рН на едро - рН оптимален ензим)
Рязко намаляване на скоростта на ензимната реакция в екстремни рН стойности е свързано с явлението денатуриране на полипептидната верига на протеиновата молекула под въздействието на киселини и основи. Ензимът показва максималната каталитична мощност при размера на рН, което се определя от термина рН-оптимум ензим. Повечето от добре познатите ензими имат оптималното рН в региона от 5.0 до 7.5. В същото време има много примери за ензими, при които рН-оптималната стойност се измества в киселинните или алкални стойности на рН. Тези ензими включват:
Причината за съществуването на зависимостта на скоростта на ензимните реакции върху рН е свързана с факта, че рН на средата има изразен ефект върху степента на йонизация на функционалните групи на субстрата. Характеристики на йонизация на молекула на янтасната киселина с различна екологична киселинност (рН):

В същото време рН на средата засяга степента на йонизация на аминокиселинни радикали, които са част от активния център на ензима:

Ако образуването на ензим-субстратния комплекс се стабилизира чрез електростатични взаимодействия, тогава ролята на рН става ясна към оптималните условия за потока на потока (фиг. 24).
Скоростта на реакциите на катализирани от ензими, в взаимодействието, чиято с субстрати нямат значителна стойност на електросталните взаимодействия в по-малка степен, зависи от рН на средата. На фиг. 32 показва зависимостта на скоростта на хидролиза на протеините на папаин. При взаимодействието на този ензим със субстрата се придобиват хидрофобни взаимодействия. Както може да се види от представената графика, папаинът няма ясно изразен рН-оптимум.

Фигура 32 - Влияние на рН върху скоростта на хидролиза на протеин папаин.
Ензимите притежават дефинирани специфичност По отношение на субстратите. При специфичност, имуществото на ензимите се подразбира да катализира трансформацията на една или група, подобна на структурата на субстратите. Има няколко вида ензимна специфичност.
· Абсолютна специфичност. Под него предполага способността на ензима да катализира трансформацията само на един субстрат. Ензимите с абсолютна специфичност включват аргина, uritica резиктаза и др.
· Относителна специфичност. Под него предполага способността на ензима да катализира трансформацията на групата с подобна в структурата на субстратите (така наречените протеолитични ензими хидролизиране различни протеини, липаза, глицеролови етери и по-високи мастни киселини, хексокиназа фосфорилира различни монозахариди). В същото време, специфичността се определя от факта, че ензимът засяга само определен тип комуникация (протеолитични ензими хидролизирани пептидни връзки, липаза хидролизи сложни основни връзки и др.).
· Стерео специализъм . При този термин предполага свойството на ензима да катализира трансформацията на един стереоизомер на субстрата. Така, ензимите, участващи в превръщането на монозахариди, показват специфичност по отношение на техните Д.Sneakersometers и ензими, участващи в трансформацията на аминокиселини - към тях Л.-Стеро-изомери.
Ензимна активност
Характеристика на ензимите като катализатори е, че те са под действието на различни външни фактори, способни да променят своите каталитични свойства. Мярка за проявлението на силата на каталитичното действие на ензимите е тяхното дейност. Способността на ензимите за промяна на тяхната активност в различни условия има голямо биологично значение. Това свойство позволява на живата клетка да адаптира състоянието на метаболитните процеси към моментите клетки, които могат да бъдат значително променени под влиянието на различни външни фактори.
Дефиницията на ензимната дейност играе важна роля за тяхната характеристика. Има някои общи принципи за количествено определяне на ензимната активност. Ензимната активност може да се определи, както следва:
· Или чрез скорост на натрупване в реакционната смес, където се намира ензимът на реакционния продукт;
· Или чрез скоростта на изчезване от реакционната смес на субстрата на ензимната реакция.
И двата подхода са еквивалентни и могат да бъдат използвани на практика. Въпреки това, при определяне на активността на ензима, трябва да се спазват следните условия: в реакционната смес, която е ензимната активност,
· Температурата трябва да отговаря на оптималната температура на този ензим;
· РН на средата трябва да съответства на рН-оптимума на този ензим;
· Концентрацията на субстрата трябва да бъде не по-малко наситена;
· Трябва да присъстват cofackers, ако този ензим е съществувал;
· Трябва да присъстват ензимни активатори.
Така активността на ензима се определя в оптималните условия за него. При тези условия ензимната активност е пропорционална на съдържанието му в проучването в извадката и следователно може да се използва за непряка оценка на нейната концентрация.
Активността на ензима се изразява количествено в единици на дейност. За една единица ензимна активност (единица) се приема активността на ензима, при която образуването на 1 μmol на реакционния продукт (или изчезването на 1 μmol на подраздема) е при негово влияние.. В системата на SI на единица ензимна активност се приема котка (CAT). 1 каталог съответства на активността на ензима, при който се случва едно молитва на реакционния продукт (изчезването на една молитва на субстрата) в секунда.
За характеристиките на ензимите се използва и стойността на специфичната активност. Тази единица отразява активността на ензима на единица от нейната маса и се изразява в μmol / min mg протеин. Единици на специфична активност се използват за оценка на чистотата на ензимните препарати. Колкото по-висока е стойността на специфичната активност, чистата ензимният препарат.
Основите на кинетиката на ензимните процеси са положени в произведенията на Michaelis и се настаняват, по-специално в уравнението на ензимен комплекс.
В кинетиката на ензимните процеси, частта на ензимната наука, която изследва зависимостта на ензимната реакция от химичното естество на субстрата, условията на средата, както и чуждестранните фактори, които влияят на хода на реакцията разбрах.
Когато концентрацията на субстрата е достатъчно голяма, тя вече не засяга скоростта, тъй като последната е станала максимална (доказателство, че целият ензим е свързан с субстрата).
Изследването на активността на ензимите се извършва при големи концентрации на субстрати (процедура за нулева реакция). При тези условия всички промени в скоростта на реакцията ще зависят само от количеството ензим. Но в живите клетки на концентрацията на субстрата, като правило, далеч от насищане на ензимите. Това означава, че ензимите в клетките не използват цялата си сила.
Зависимостта на ензимната реакция от количеството ензим
Ако субстратът е в излишък, който практически се осъществява при експериментални условия, скоростта на реакцията е пропорционална на количеството ензим. Но ако количеството ензим се увеличи така, така че субстратът да не е в излишък, тогава такава пропорционалност ще наруши.
Скоростта на ензимната реакция е линейно увеличаване с увеличаване на ензимното съдържание. Но прекомерното увеличаване на концентрацията на ензима води до факта, че субстратът става по-малък от ензима и това се проявява с намаление на увеличаването на скоростта на реакцията.
Въздействие върху ензимите на модулатори
Дейността на ензимите може да варира не само чрез промяна на броя на субстрата, ензима, рН на средата, но и под влиянието на различни химикали. Веществата, засягащи хода на ензимните реакции, се наричат \u200b\u200bмодулатори или ефектори. Те са разделени на активатори и инхибитори, т.е. при тяхното влияние, реакцията може да ускори или забави. Изследването на действието на ензимните модулатори е практично, тъй като ви позволява да по-дълбоко естеството на ензимното действие. Някои от тях играят ролята на естествени метаболитни регулатори. Има много видове модулатори на ензим, които се различават един в друг в структурата и механизма за действие.
ензими за активатори
Ролята на активаторите може да възпроизвежда както органични (жлъчни киселини, ензими и др.) И неорганични вещества (метални йони, аниони). Често има случаи, когато едно и също вещество за един ензим е активатор и по отношение на друг инхибитор. Металните йони са много специфични активатори за определени ензими. Те могат да допринесат за закрепването на субстрата към ензима, да участват в образуването на третичната структура на ензима или да бъдат част от активния център. Йони на много метали (натрий, калий, калций, магнезий, желязо, мед и др.) Са задължителни компоненти, които са необходими за нормалното функциониране на много ензими. Понякога за някои ензими се нуждаете от няколко различни йони. Например, за Na +, K + -ATPHASE, извършване на превоз на йони през плазмената мембрана, необходима за нормалното функциониране на калиевите йони, натрий и магнезий.
Металите могат да бъдат част от протезна група от ензими. Например, желязото в състава на порфириновите съединения е необходим компонент на ензимите на цитохромната система, каталаза и пероксидаза; Кобалтът е включен в протезната група на хомоцистейненезамемелаза и метилмалонилизомераза на ензимите; мед - до аскорбатоксидаза; Манганът е активатор изоцитрат дехидрогеназа.
Метални почистващи вещества, съдържащи главно две- и тривалентни йони, се образуват с остатъци от функционалните групи аминокиселини и съответните лепилообразни кокини. В такива съединения йоните имат ензими на определена пространствена структура и допринасят за формирането на ензимни брифинг комплекси. Някои ензими в отсъствието на метали просто не показват ензимно действие. Например, карбондънс без цинк няма свойствата на ензима, а действието на цинк не може да бъде заменено с друг йон.
Има група ензими, активирани от CAMF. Такива ензими се наричат \u200b\u200bпротеинови кинази. Механизмът на тяхното активиране е такъв. Протейнказаза се състои от две субединици: каталитичен, съдържащ активен център и регулаторен, в който се намира центърът на свързването на CAMF. Ензимът е неактивен, защото активният му център е затворен. Тя се освобождава само в взаимодействието на С-усилвателния и регулаторния център на ензима.
Ензимните кинетики изследват скоростта на реакциите, катализирани от ензими в зависимост от различните условия (концентрация, температура, рН и т.н.) от тяхното взаимодействие с субстрата.
Въпреки това, ензимите са протеини, които са чувствителни към ефекта на различни външни влияния. Следователно, при изучаване на скоростта на ензимните реакции, главно концентрацията на реакцията на вещества и ефекта на температурата, рН на средата, активащите, инхибиторите и други фактори се опитва да сведе до минимум и създаване на стандартни условия. Първо, тя е оптимална за ензимната стойност на околната среда. Второ, се препоръчва да се прилепват до температура 25 ° C, в случаите, когато е възможно. Трето, достигайте пълно насищане на ензима от субстрата. Тази точка е особено важна, тъй като при ниска концентрация на субстрата, не всички ензимни молекули фокусират се в реакцията (Фиг. 6.5, \\ t но), това означава, че резултатът ще бъде далеч от възможно най-голям максимален. Най-голямата сила на катализираната реакция, с други равни неща, се постига, ако всяка ензимна молекула е включена в трансформацията, т.е. при висока концентрация на ензим-субстратния комплекс (фиг. 6.5, в). Ако концентрацията на субстрата не осигурява пълна насищане на ензима (Фиг. 6.5, б.), скоростта на течащата реакция не достига максималната стойност.
Фиг. 65.
но - при ниска концентрация на субстрат; 6 - с недостатъчна концентрация на субстрата; в - С пълна ензимна насищане с субстрат
Скоростта на ензимната реакция, измерена, когато изброените изброени условия и пълната насищане на ензима се нарича субстрат максимална скорост на ензимна реакция (V).
Показва се скоростта на ензимна реакция, определена чрез непълна насищане на ензимния субстрат, v.
Ензимната катализация опростена може да бъде описана по схемата

където f е ензим; S - субстрат; FS - комплекс за ензим-субстрат.
Всеки етап от този процес се характеризира с определена скорост. Устройството за измерване на скоростта на ензимната реакция е броят на молците на субстрата, преобразувани на единица време (както и скоростта на обичайната реакция).
Взаимодействието на ензима с субстрата води до образуването на ензимен субстрат, но този процес е обратим. Скоростта на директните и обратните реакции зависи от концентрациите на реагентите и са описани от съответните уравнения:
В състояние на равновесие, уравнението (6.3) е вярно, тъй като скоростта на директната и обратната реакция са равни.
Подразбиращи се стойностите на скоростта на директно (6.1) и обратни (6.2) реакции към уравнение (6.3), ние получаваме равенство:
Състоянието на равновесието се характеризира със съответното равновесие постоянен до r, равен на съотношението на преките и обратните реакционни константи (6.5). Стойността, връщащата константа на равновесието, се нарича субстрат постоянен K S, или дисоциация постоянен комплекс за ензим-субстрат:

От уравнение (6.6) е ясно, че константата на субстрата намалява с висока концентрация на ензим-субстратния комплекс, т.е. Със своята голяма стабилност. Следователно, основата на субстрата характеризира афинитета на ензима и субстрата и съотношението на скоростта на образуване и дисоциация на ензим-субстратния комплекс.
Феноменът на ензимния наситен субстрат е изследван от Leonor Michaelis и Madeten Madeten. Въз основа на математическата обработка на резултатите е получено уравнение (6.7), което е получило техните имена, от които е ясно, че с висока концентрация на субстрата и ниската стойност на константа на субстрата, скоростта на ензимната реакция. се стреми да максимизира. Това уравнение обаче е ограничено, защото не всички параметри вземат под внимание:
Ензимният субстрат комплекс в реакционния процес може да бъде трансформация в различни посоки:
- дисоцииране към изходни материали;
- Се превръща в продукт, от който ензимът се разделя непроменен.
Следователно, за да се опише общото действие на ензимния процес, концепцията е въведена константи Michaelis K T, което изразява връзката на константи на скоростите на всичките три реакции на ензимен катализатор (6.8). Ако и двата компонента са разделени в скоростта на образуване на ензим-субстратния комплекс, експресията (6.9) ще бъде получена:

От уравнение (6.9) следва важна последица: Mikhailis постоянната е винаги повече субстрат за величина k 2 / k V
Числен До Т. Такава концентрация на субстрата е еднаква, при която скоростта на реакцията е наполовина максималната възможна скорост и съответства на такава насищане на ензима от субстрата, както на фиг. 6.5, б.Тъй като на практика не винаги е възможно да се постигне пълна насищане на ензима от субстрата, тогава До Т. Използва се за сравнителната характеристика на кинетичните характеристики на ензимите.
Скоростта на ензимната реакция с непълна наситеност на ензимния субстрат (6.10) зависи от концентрацията на ензим-субстратния комплекс. Съотношението на пропорционалността е константата на реакцията на освобождаване на ензима и продукта, тъй като тя променя концентрацията на ензим-субстратния комплекс:
След трансформации, като се вземат предвид представените по-горе зависимост, скоростта на ензимна реакция с непълна насищане на ензимния субстрат е описана чрез уравнение (6.11), т.е. Зависи от концентрациите на ензима, субстрат и тяхната афинитет K S:
Графичната зависимост на скоростта на ензимната реакция от концентрацията на субстрата не е линейна. Както е очевидно от фиг. 6.6, с увеличаване на концентрацията на субстрата се наблюдава увеличаване на активността на ензима. Въпреки това, когато максималната насищане на ензима се достигне със субстрата, скоростта на ензимната реакция става максимална. Следователно, факторът, ограничаващ скоростта на реакцията, е образуването на ензим-субстрат.
Практиката показва, че концентрациите на субстратите обикновено се изразяват от стойностите на много по-малко от един (10 6 -10 3 mol). Работейки с такива стойности в изчисленията е доста трудно. Ето защо, град Линувърът и Д. Берк предложи да изразят графичната зависимост на процента на ензимната реакция, а не в директни координати, но в обратното. Те пристъпиха от предположението, че за еднакви стойности, равни на стойностите на тях:

Фиг. 6.6.
След превръщането на експресията (6.13) се получава експресия linuiver уравнение - бар (6.14):
Графичната зависимост на уравнението на лините е линейна в природата (фиг. 6.7). Кинетичните характеристики на ензима се определят, както следва:
- Рязането на оста на определението е равно на 1 / V;
- Прекъсване, което се отрязва на оста на абсцисата е -1 / K t.

Фиг. 6.7.
Смята се, че методът на Linuiver - Berk позволява по-точно, отколкото в директни координати, за да се определи максималната скорост на реакцията. От този график можете също така да извлечете ценна информация относно инхибирането на ензима.
Има и други начини за трансформиране на уравнението на Michaelis - Menage. Графичните зависимости се използват при изучаване на ефекта на различни външни влияния върху ензимния процес.
Този раздел на ензимологията изследва ефекта от различни фактори за скоростта на ензимна реакция. Като се има предвид общото уравнение на ензимната катализа на обратимата реакция на трансформацията на един субстрат в един продукт (1), \\ t
основните фактори на влиянието върху скоростта на ензимната реакция трябва да се нарекат: концентрацията на субстрата [s], концентрацията на ензима [е] и концентрацията на реакционния продукт [p].
Взаимодействието на някои ензими със своя субстрат може да бъде описано чрез хиперболична крива на зависимостта на скоростта на ензимната реакция V от концентрацията на субстрата (фиг. 19):

Фиг.19. Зависимост на скоростта на ензимна реакция от концентрацията на субстрата.
Три области могат да бъдат разграничени по тази крива, които могат да бъдат обяснени с разпоредбите на ензимния механизъм за взаимодействие с субстрата: OA - парцел пряко пропорционална зависимост V от [S], има постепенно пълнене на активни ензимни центрове с a субстрат молекули за образуване на нестабилен ес комплекс; Обхватът на AV е криволинейна зависимост v от [s], пълната насищане на активните ензимни центрове с субстратните молекули все още не е постигната. Комплексът преди достигане на преходната държава е нестабилен, вероятността за обратна дисоциация към Е и S е все още голяма; Парцелът на самолета - зависимостта е описан от уравнението на нулевия ред, частта на паралелната ос [S], постигана общата наситеност на активните ензими на субстратните молекули, v \u003d v max.
Характерната форма на кривата е описана чрез математически от уравнението на Briggs-Handane:
V \u003d v max ● [s] / km + [s] (2),
когато km е постоянен mihaelis-menten, числено равен на концентрацията на субстрата, при който скоростта на ензимната реакция е равна на половината от V max.
Колкото по-малко k m ензим, толкова по-висок е афинитетът на ензима към субстрата, толкова по-бързо, преходното състояние се постига за субстрата и се превръща в реакционен продукт. Търсене Стойностите на KM за всеки от ензимните субстрати с групова специфичност е важен при определянето на биологичната роля на този ензим в клетката.
За повечето ензими е невъзможно да се конструира хиперболична крива (фиг. 19), в който случай се използва методът на двойни обратни стойности (Linuiver-bar), т.е. Графична зависимост от 1 / [V] е изградена от 1 / [s] (фиг.20). Методът за конструиране на такива криви в експеримента е много удобен при изучаването на влиянието на различни видове инхибитори върху ензимната активност (вж. Текста допълнително).

Фиг.20. График на зависимост 1 / [v] от 1 / [s] (метод на Linuer-bar),
където y-cut-off район - и x - зоната на прекъсване -  , Допиращ ъгъл α -.
, Допиращ ъгъл α -.
Зависимостта на скоростта на ензимна реакция V от концентрацията на ензима [е].
Тази графична зависимост (фиг.21) се разглежда при оптималната температура и рН на околната среда, при концентрации на субстрата, значително надвишават концентрацията на насищане на активните ензимни центрове.

Фиг. 21. Влиянието на ензимната концентрация върху скоростта на ензимна реакция.
Зависимостта на скоростта на ензимната реакция от концентрацията на кофактора или козел. За сложни ензими трябва да се има предвид, че дефицитът на витамини в хиповитаминоза, нарушение на потока от метални йони задължително води до намаляване на концентрацията на съответните ензими, необходими за потока на метаболитни процеси. Следователно трябва да се сключи за пряката зависимост на ензимната активност от концентрацията на кофактора или козел.
Влиянието на концентрацията на продукти върху скоростта на ензимна реакция. За обратими реакции, настъпили в човешкото тяло, е необходимо да се вземе под внимание, че продуктите на реакцията могат да бъдат използвани от ензима като субстрати на обратната реакция. Следователно, посоката на потока и момента на постигане v max зависят от връзката между концентрациите на субстратите на източника и реакционните продукти. Например, активността на катализиращата трансформация на аланин-сафероза:
Alanine + Alpha Ketoglutarat ↔ Piruvat + глутамат
зависи от клетката от съотношението на връзката:
[Alanine + Alpha Ketoglutarata] / [Piruvat + Glutamate].
Механизма на действие на ензимите. Теории за ензимно катализа
Ензими, като не-протеинови катализатори, повишаване на скоростта на химична реакция поради способността за намаляване на енергията на активиране на тази реакция. Активиращата енергия на ензимната реакция се изчислява като разликата между енергийната стойност в системата на течащата реакция, която е достигнала преходната държава и енергията, определена в началото на реакцията (виж графичната зависимост Фиг. 22).

Фиг. 22. Графичната зависимост на енергийното състояние на химическата реакция без ензим (1) и в присъствието на ензим (2) върху времето на потока на реакцията.
Работи В. Хенри и, по-специално, L. Michaelis, M. Mentena да проучи механизма на моносилуматични реверсивни ензимни реакции, разрешени да поправят, че ензимът е първобр. . \\ T
E + S.<=> ES (1)
Се дължат на водородни връзки, електростатични, хидрофобни взаимодействия, в някои случаи ковалентни, координационни връзки между страничните радикали на аминокиселинните остатъци на активния център и функционалните групи на субстрата. В сложни ензими функцията за контакт с субстрата може да се извърши и чрез незелена част на структурата.
Ензим-субстратният комплекс се разпада във втората по-бавна реверсивна реакция към образуването на продукта на R и свободния ензим Е:
. \\ T<=> Ело<=>E + p (2)
Понастоящем, благодарение на произведенията над тези учени, както и Cailin D., Chanza B., Koshend D. (теорията на "индуцираното съответствие"), съществуват теоретични разпоредби относно четирите основни точки в механизма на действие на ензим на субстрата, определящ способността на ензимите да се ускорят химическите реакции:
1. Ориентация и сближаване . Ензимът е способен да свързва субстратната молекула по такъв начин, че връзката, атакувана от ензима, се оказва не само в непосредствена близост до каталитичната група, но също така и правилно ориентирана към нея. Вероятността, че комплексът на ЕС ще достигне преходното състояние по ориентация и сближаване, е значително увеличава.
2. Напрежение и деформация : предизвикано спазване. Добавянето на субстрата може да причини конформационни промени в ензимната молекула, които водят до напрежението на структурата на активния център, както и донякъде деформират свързания субстрат, като по този начин по-лесно постигане на постигането на състоянието на прехода. Налице е така нареченото предизвикано съответствие между молекулите Е и С.