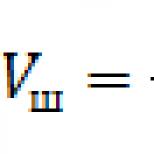Boyle-Marriott zakon. Gasni zakoni izoterma. Dihanny Boyleov zakon - Marriott Boyleov zakon Marriott Rizne formulacija
Pređimo sada na prijavljene promjene u ishrani, kako se mijenja pritisak tečne mase na plin, kako njegova temperatura postaje nepromjenjiva i mijenja se bez da se gas troši. Već smo znali zašto je ovo izotermni Proces se odvija kako bi se osiguralo da temperatura tijela ostane konstantna, kako bi plin mogao izaći, a protok plina se stalno mijenja tako da se temperatura plina tokom procesa ne mijenja sa temperaturom viška tijela. Postavljamo ovaj red ishrane: kako su pritisak i pritisak međusobno povezani tokom izotermne promene? Dobra je vijest imati na umu da kada se dovod tekućine do plina promijeni, njegov pritisak raste. Kao kundak, možete označiti elastičnost prilikom naduvavanja gume za fudbalsku loptu, bicikl ili automobil. Napajanje se zaustavlja: kako se povećava pritisak na plin kada se dovod promijeni, kada temperatura plina ostane nepromijenjena?
Ovu ishranu su potvrdila istraživanja koja su u 17. veku razvili engleski fizičar i hemičar Robert Bojl (1627-1691) i francuski fizičar Edem Marriot (1620-1684).
Nakon ugradnje razmaka između volumena i tlaka plina, možete to učiniti: na okomitom postolju , pečena na pola, tu je staklena cijev Aі IN, spojena humum cijevi C. Cijev je napunjena živom. Cijev je otvorena, a na cijevi A postoji slavina. Zatvorimo ovu slavinu i tako zatvorimo protok vode u blizini cijevi A. Iako ne uklanjamo cijevi, količina žive u obje cijevi je i dalje ista. To znači da je pritisak vjetra zatvoren u cijevi A, baš kao pritisak previše vetra.
Sada možemo potpuno da podignemo slušalicu U. Vjerujemo da živa u obje cijevi raste, ali ne u cijevi UŽivina rabarbara će biti viša cijelo vrijeme, niža na A. Ako spustite cijev B, tada će se živina rabarbara u oba stupca smanjiti, ali u cijevi U smanjiti više, niže A. Količina zraka zatvorenog u cijevi A, može se držati iza cijevi A. Pritisak ovog vazduha raste od atmosferskog pritiska za vrednost pritiska žive, čija visina predstavlja trenutnu razliku nivoa žive u cevima A i B. Kada. Podigni slušalicu U Pritisak žive se dodaje atmosferskom pritisku. Zapremina zraka u A se mijenja. Kada se cijev spusti U nivo žive u njemu izgleda niži nego u A, a pritisak žive raste od atmosferskog pritiska; zapremina vazduha u A
Definitivno će se povećati. Na ovaj način se obrćuju vrijednost pritiska i zapremine cijevi zatvorene u cijevi A, tako da se povećanjem volumena mase pritisak iste mijenja nekoliko puta, I to slučajno. Temperatura zraka u cijevi može se održavati konstantnom za naša zapažanja. Slični rezultati se mogu dobiti i sa drugim gasovima. Rezultati su isti. otje,
Pritisak tečne mase na gas pri konstantnoj temperaturi proporcionalan je protoku gasa (Boyle-Marriottov zakon). Za razrijeđene plinove Boyle-Marriott zakon dostiže visok nivo
tačnost. Za gasove koji su visoko komprimovani ili rashlađeni postoje značajne razlike u skladu sa ovim zakonom. Formula koja izražava Boyle-Marriott zakon.
Istraživanje velikog engleskog naučnika Boylea rodilo je ljude nove hemijske nauke. Hemiju je vidio kao samostalnu nauku i pokazao da ona ima svoje probleme, svoje zadatke, koje je potrebno rješavati svojim metodama, različitim od medicine. Sistematizujući numeričke reakcije boje i reakcije precipitacije, Boyle je pokrenuo analitičku hemiju. Postao je autor jednog od prvih zakona fizičke i hemijske nauke koji je popularizovan.
Robert Boyle (1627-1691) bio je trinaesto dijete od četrnaestoro djece Richarda Boylea, prvog vojvode od Corka, žestokog i uspješnog ljubitelja bogatstva, koji je živ u vrijeme kraljice Elizabete i umnožio je svoj uspjeh u pljački stranih zemljišta. Rođen je u dvorcu Lesmore, jedan od irskih očeva. Robert je tamo proveo svoje djetinjstvo. Postigavši čuda kod kuće, nakon osam godina postao sam student na Univerzitetu Eton. Tamo je proživio četiri sudbine, nakon čega je njegov otac Stolbridge otišao na nove matične ploče.
Kao što je u to vrijeme bio običaj, sa dvanaest godina Robert i njegov brat poslani su putevima Evrope. Odlučićete da nastavite studije u Švajcarskoj i Italiji i tamo ste proveli šest godina. Boyle se vratio u Englesku tek 1644. godine, nakon smrti svog oca, koji ga je lišio značajnog položaja.
Stolbridge je bio zadužen za laboratoriju u kojoj je do kraja 1645. godine vršio istraživanja iz fizike, hemije i poljoprivredne hemije. Boyle je volio rješavati toliko problema odjednom. Pozovite na izvještaj, objasnite asistentima šta ćete morati raditi za taj dan, a zatim idite u kancelariju, gdje ga sekretarica provjerava. Tamo je diktirao svoje filozofske rasprave.
Naučni enciklopedista, Boyle bavi se problemima biologije, medicine, fizike i hemije, ne pokazujući ništa manje interesovanje za filozofiju, teologiju i nauku. Boyle je laboratorijskim istraživanjima dao značajan značaj. Najkorisniji i najraznovrsniji proizvodi bili su rezultati hemije. Cijenimo da hemija, spojivši se sa alhemijom i medicinom, može postati samostalna nauka.
Od samog početka, Boyle je počeo da vadi infuzije iz cvijeća, bilja, lišajeva, kore drveća i korova. Najuočljivija je bila infuzija ljubičice ekstrahirana iz lakmusovog lišaja. Kiseline su promijenile boju u crvenu, a livade u plavu. Boyle je naredio da se papir namoči u ovu infuziju i zatim osuši. Sveska takvog papira, umorna od isprobavanja vina, mijenjanja boje i prikazivanja koliko su vina kisela, a koliko kisela. Ovo je bio jedan od prvih govora koje je Boyle također nazvao indikatorima.
Pažljiva učenja pratila je sve veća moć vlasti: ako se prije sječe drva u dušičnu kiselinu doda malo hlorovodonične kiseline, stvorio se bijeli talog, koji je Boyle nazvao "mjesec rožnjače" (drvni hlorid ). Kako su ove opsade bile lišene otvorenog plovila, Černovci. Uslijedila je analitička reakcija koja pouzdano pokazuje da sljedeći govor sadrži “mjesec” (sreeblo).
Mladi su sumnjali u univerzalnu analitičku valjanost vatre i drugih metoda analize. Brojne studije su pokazale da ako je govor izložen ovim ili drugim reagensima, smrad se može proširiti na najjednostavnija čula. Vikoristic i specifične reakcije bi se mogle naznačiti. Neki ljudi su stvarali fermentirani otpad, drugi su vidjeli plin s karakterističnim mirisom, a treći su davali fermentirani otpad. Boyle je proces razgradnje i identifikacije izlučenih proizvoda nazvao analizom dodatnih karakterističnih reakcija. Riječ je o novom načinu rada, koji je poštanskim radnicima dao razvoj analitičke hemije.
Godine 1654. preselio se u Oksford, gdje je nastavio svoje eksperimente sa svojim pomoćnikom Wilhelmom Gombergom. Istraživanja su se svela na jedan cilj: sistematizirati govore i podijeliti ih u grupe prema ovlaštenjima.
Nakon Homberga, mladi fizičar Robert Hooke postao mu je asistent. Svoja istraživanja su uglavnom posvetili plinovima i razvoju korpuskularne teorije.
Saznavši iz naučnih publikacija o radu njemačkog fizičara Otta Guerickea, Boyle je odlučio ponoviti svoj eksperiment i iz istog razloga koristiti originalni dizajn vjetropumpe. Prvi uvid u ovu mašinu postignut je uz pomoć Hookea. Istraživači su uspjeli u potpunosti ukloniti vodu pomoću pumpe. Svi pokušaji da se osigura prisustvo etra u praznoj posudi postali su marinski.
"Žedni etar ne presušuje", rekao je Boyle, nakon što je završio svoje istraživanje. Prazan prostor u venama obično se naziva vakuum, što na latinskom znači „prazan“.
Godine 1660. Boyle je izvršio svoj prvi zadatak velikom naučnom robotu - "Novi fizičko-mehanički eksperimenti ako se vratite i pokažete." Knjiga "Hemičar - skeptik" postala je proboj. U ovim knjigama, Boyle ne ostavlja kamen na kamenu o Aristotelovom uvažavanju mnogih elemenata koje je pronašao
dve hiljade stena, kartezijanski "etar" i tri alhemijska tla. Naravno, ovaj proces je izazvao oštre napade sljedbenika Aristotela i kartuzijanaca. Prote Boyle se skrivao od nekog drugog, a njegov dokaz je bio nepobitan. Većina naučnika - sljedbenika korpuskularne teorije - usvojila je Boyleove ideje iz blaga. Mnogi od njegovih ideoloških protivnika također su bili zbunjeni ovim otkrićem.
Novi asistent u njegovoj oksfordskoj laboratoriji je mladi fizičar Richard Townley. U isto vrijeme, Boyle je otkrio jedan od fundamentalnih zakona fizike, utvrđujući da je promjena protoka plina proporcionalna promjeni tlaka. To je značilo da je, znajući promjenu u dužnosti sudije, bilo moguće precizno odrediti promjenu tlaka plina. Ovo je postalo najveće otkriće 17. veka. Boyle ju je prvi put opisao 1662. godine ("Za zaštitu elastičnosti vjetra") i skromno je nazvao hipotezom.
Koncept napetosti opruge, koji odgovara novom konceptu poroka, bio je primarni u idejama kasnijih Boyleovih istraživanja.
„Prolećnost vjetra“, piše Liozzi, „je pokazao Pascal prije testa, koji su ponovili Akademija za istraživanje i Heritsa. Sijalica će se zapuhati na vjetru ako je stavite u barometarsku komoru ili u rezervoar iz kojeg se pumpa vjetar. Gerickeov dokaz o dva plovila koje je dobio također svjedoče o elastičnosti vjetra.” Važno je napomenuti da je iz opisa istraživanja proizašla teorija elastičnosti. Ovaj termin, koji je skovao Pecke 1651. godine, naširoko je prihvatio Boyle, koji je također napravio prve studije elastičnosti čvrstih tijela.
Frančesko Lino (1595-1675), koji se u suštini zalagao za ideje koje je izneo Fabri, kao i Mersen, koji je želeo da pripiše Torricelli efekat i vlaženje vode pumpom, odvajajući „usisne“ čestice vode, su se zauzeli. oružje protiv takvog rasuđivanja. I opet se drže jedno za drugim. U svom djelu “O eksperimentu sa živom u staklenim cijevima...”, objavljenom 1660. godine, Leno objašnjava kako spustiti cijev u živu, otvoriti na oba kraja, a zatim prstom pokriti gornji kraj i često Kako povući cijev od žive, tada možete osjetiti kako se jastučić vašeg prsta uvlači u sredinu cijevi. Ts Zerinnya, Mirku, Dali Líno, ne o nazivanju atmosferske viske, već o unutrašnjoj moći, bogaju nevidljivih niti („funky“) majčinskih ljudi, sa izbacivačem sa jednim kinetom, i sa rosmom usta.
Istovremeno, takve ideje mame vas na osmijeh, ali zahtijevaju i ozbiljno razmatranje, naučivši od Boylea u svom djelu „Odbrana od Lenoa“, i zadajte sebi cilj da shvatite da će se proljetnost ponovo stvoriti u više, manje jednostavnom , jutra."Toričelijeva mana."
Boyle nezaboravno opisuje svoje istraživanje: „Uzeli smo dugačku čašu lule, jer je sa majstorskom rukom iza nje lampa bila savijena na takav način da je savijeni dio lampe bio gotovo paralelan sa ustima. Otvor ovog kratkog... bio je hermetički zatvoren. Kratko koljeno kroz cijeli životni vijek podijeljeno je na inče (koža svake pregrade na cijelom dijelu) pomoću papira na koji je nanesen papir, koji je pažljivo zalijepljen za cijev.” Upravo je ovaj papirni papir bio zalijepljen na dugačku točku. Zatim je cijev ispunjena "živom u takvoj zapremini da je ispunila okrugli ili zakrivljeni dio sifona" i stajala na istoj razini u oba stupa. “Kada je zdrobljena, počeli smo da dodajemo živu u drugu cijev... sve dok kraj kratke cijevi nije pokazao da se pritisak toliko promijenio da je zauzeo samo polovicu prvobitne zapremine... t skrenemo pogled sa prethodne cijevi... "Primijetili smo da je živa na ovom kraju cijevi bila 29 inča viša nego na drugom."
Dajući podršku ovim eksperimentima, Boyle je primetio: „Kada je sto bio stisnut u vazduhu, bio je zgusnut u zapremini koja je činila jednu četvrtinu klipa, pokušali smo, koliko je hladan, sa lanenom krpom natopljenom vodom, Vjetar se gusti. I sat vremena se činilo da postaje previše zategnuto, tako da nije bilo poda na kojem bi se radilo sa bilo kakvim pričvršćivačima. Onda smo probali i toplotu... širenje vazduha; Kada se polovina svijeće približila tom dijelu, gdje je bila položena na vjetru, pokazalo se da je toplina više uočljiva nego hladno.”
Tsikavo, da nije Boyle, već Townley došao do dokaza iz istrage. Boyle ističe da je Richard Townley, čitajući svoje prvo djelo, "Novi fizičko-mehanički eksperimenti na oprugama", došao do hipoteze da su "pritisak i povlačenje unazad proporcionalni jedno drugom".
Ya.G. Dorfman piše: "Petnaest godina nakon objavljivanja ovih Boyleovih studija, tada 1679. godine, Francuska je dobila "Muškarac o prirodi vjetra" Abbe Edma Marriott, kojim su slični stručnjaci opisali druge dijete. Prema Boyleovim riječima, rezultat dugog vremenskog perioda između pritiska vjetra i hajde da se zaposlimo. Marriott ne govori ni riječi o svom nasljedniku, iako je Boyleov rad s pneumatikom potpuno nepoznat. Do tada je Boyleov rad bio nadaleko vidljiv: smrad je objavljen na latinskom i engleskom jeziku. Istovremeno, Marriott nije zaboravio pogoditi svog nasljednika, pa čak i 1673., kada je govorio o braku vina, ne rekavši ni riječi o Huygensovom radu, postavljajući ne samo eksperimentalnu metodu, već i osnovu teorije.
Marriottov rad značajno žrtvuje Boyleov rad zarad žara za eksperiment. Boyle, kao što smo saznali, izračunava visinu mješavine žive s točnošću od šesnaestine inča, što čovjeka čini zaista opreznim prema vrijednostima proračuna i upozorava na skoru krađu vimira. Marriott pokazuje visinu žive u cijelim inčima i navodi da su najnoviji podaci striktno u skladu sa skalom. Pažljiv i kritičan, Boyle zakon koji je stvorio naziva samo “hipotezom” koja zahtijeva eksperimentalnu potvrdu. Marriott to naziva zakonom i vladavinom prirode. Dakle, pošteno rečeno, “Boyle-Marriott zakon” se može nazvati “Boyle-Townley-ev zakon” ili “Boyle-Townley-Hooke”. Nažalost, ponekad na kursevima fizike, Milkovo se učvrsti, ali Marriott je “razjasnio” Boyleovo istraživanje, koje ne pokazuje valjanost.”
Prote Marriott (1620-1684) prenio je masakr na zakon. Među njima je najvažnije odrediti visinu mjesta na osnovu podataka barometra. Rozrakhunok, koji se izvodi na način rada sa beskonačno malim količinama, pozivajući se na nesretan rezultat slabe matematičke pripreme prošlosti.
Kasnije, 1686. godine, engleski astronom Edmond Halley (1656 - 1742) postao je svjestan problema izračunavanja atmosferske visine. Većina čitalaca zna da se pod njegovim imenom nalazi kometa. Dakle, osa, Halley zna da je formula, u suštini, tačna, jer ne mijenja temperaturu. Suština Halejeve formule svela se na tvrdnju da se sa povećanjem visine u aritmetičkoj progresiji, atmosferski pritisak menja u geometrijskoj progresiji.
Yak mi dikhaemo?
Volumen zraka između nožnih sijalica i vanjskog jezgra mijenja se kao rezultat ritmičkih disajnih pokreta prsnog koša. Kada udišete, povećava se volumen grudnog koša i noge, pri čemu se pritisak na njih smanjuje i struji kroz disajne puteve (nos, grlo) da bi ušao u lukuvicu noge. Kada se promijeni volumen stijenke grudnog koša, pritisak na sijalice grudnog koša se pomiče i višak ugljičnog oksida (ugljični dioksid) izlazi iz grudnih sijalica. Ovdje stupa na snagu Boyle-Marriott zakon, tako da je skladište pod pritiskom.
Koliko dugo ne možemo umrijeti? Čak i obučeni ljudi mogu stegnuti dah na 3-4 i na 6 minuta, ali ne više. Više od toga, kiselo gladovanje može dovesti do smrti. Zbog toga kisen postepeno ulazi u organizam. Dihanija je prenos kiselosti sa tela na ostatak tela. Glavni organ dihotomijskog sistema
- Pluća, uključujući pleuralno područje.
Zasnovano na Boyle-Marriott zakonu
Zakoni o plinu se aktivno praktikuju u tehnologiji i živoj prirodi i široko se koriste u medicini.
Boyle-Marriott zakon počinje da se „važi za ljude“ (kao i za sve ljude) od trenutka njihove nacionalnosti, od prve samostalne smrti.
Kada se interkostalni mišić rastereti, dijafragma povremeno mijenja volumen grudnog koša. Ako se zid grudnog koša širi, tada pritisak vjetra na noge pada niže od atmosfere. “zahtijeva” izotermni zakon (pv=const), a kao rezultat pada tlaka, koji se, slegnuvši, izdiše.
Dikhannya legeneve: difuzija gasova u legenama
Da bi razmena difuzionog puta bila efikasna, površina razmene mora biti velika, a površina difuzije mala. Prepreka difuzije u nogama u potpunosti se slaže sa ovim umovima. Površina alveola treba biti približno 50 - 80 kvadratnih metara. m. Zbog svojih strukturnih karakteristika, tkanina noge je pogodna za kreativnu difuziju: krovne kapilare su ojačane u alveolarnom prostoru najtanjom klupkom tkanine. Tokom procesa difuzije kiselost prolazi kroz alveolarni epitel, intersticijski prostor između glavnih membrana, kapilarnog endotela, krvne plazme, membrane eritrocita i unutrašnjeg jezgra eritrocita. Ukupna difuzna vrijednost postaje približno 1 mikron.
Molekule ugljičnog dioksida difundiraju duž ovog puta, i to direktno od eritrocita do alveolarnog prostora. Međutim, difuzija ugljičnog dioksida postaje moguća tek nakon oslobađanja njegovog kemijskog vezivanja iz drugih spojeva.
Kada crvena krvna zrnca prođe kroz kapilare noge, trajanje moguće difuzije (sat kontakta) je očigledno malo (oko 0,3 s). Međutim, ovaj sat je sasvim dovoljan da se pritisak respiratornih gasova u krvi i parcijalni pritisak u alveolama praktično izjednače.
Važno je izračunati respiratorni volumen i vitalni kapacitet noge.
svrha: znači volumen disanja i životni kapacitet noge.
Obladnannya: Torba je uvrnuta, šav je izblijedjel.
Sakrij robote :
Torba je naduvana što je više moguće za N (2) mirnih pogleda.
Mjerimo prečnik vrećice i njen proširivi volumen pomoću formule:
De d je prečnik couleea.
Broj vrsta se može izračunati: , gdje je N broj vrsta.
Moguće je da je torba još dva i da se izračuna prosječna vrijednost fizičkog volumena njenih nogu
![]()
![]()
![]()
Značajni vitalni kapacitet (VC) je najveća količina zraka koju osoba može doživjeti nakon dubokog udaha. Za to, ne dižući vrećicu iz usta, duboko udahnite kroz nos i duboko udahnite kroz usta na vrećicu. Ponovimo 2 puta. de N=2.
Roberta Boylea i direktno preveo Edmus Marriott 1676. Opisuje ponašanje plina u izotermnom procesu. Prema modernoj fizici, zakon je zaostavština Klapejrona - Mendeljeva.Formula
Pridržavanje Boyle-Marriott zakona je na snazi:
U matematičkom obliku, iskaz je napisan u obliku formule
p V = C , (\displaystyle pV = C,)de p (\displaystyle p)- Pritisnite gas; V (\displaystyle V)- pritisni gas, i C (\displaystyle C)- Veličina je konstantna u umovima umova. Za zagal vipadku značenje C (\displaystyle C) označen je njegovom hemijskom prirodom, masom i temperaturom gasa.
Očigledno, šta je indeks 1 vrijednost vrijednosti koje se nalaze prije plina, i indeks 2 - Do kraja, onda se data formula može zapisati u formu
p 1 V 1 = p 2 V 2 (\displaystyle p_(1)V_(1)=p_(2)V_(2)).Iz rečenog i iz datih formula vidimo pritisak gasa u izotermnom procesu:
p = CV. (\displaystyle p=(\frac (C)(V)).)Ovo skladište je drugačije, ekvivalentno prvom, umjesto Boyle-Marriottovog zakona. Pobijedio to znači
Pritisak date mase gasa, koji je na konstantnoj temperaturi, proporcionalan je njegovoj zapremini.
Veza između krajnjeg i krajnjeg gasa koji učestvuju u izotermnom procesu može se izraziti na sledeći način:
p 1 p 2 = V 2 V 1 . (\displaystyle (\frac (p_(1))(p_(2)))=(\frac (V_(2))(V_(1))).)Treba napomenuti da stagnacija smjese i rezultirajuće formule, koja povezuje kotač i krajnje spone i zapremine plina jedan po jedan, nije ograničena pojavom izotermnih procesa. Formule više ne vrijede ako se temperatura mijenja tokom procesa, ali je kao rezultat procesa krajnja temperatura jednaka krajnjoj temperaturi.
Važno je pojasniti da ovaj zakon važi samo u ovim situacijama, kada se ovaj gas može smatrati idealnim. Zokrema, sa velikom preciznošću, Boyle-Marriott zakon određuje udio razrijeđenih plinova. Ako je gas veoma jak, onda se mora paziti da se ne poštuje ovaj zakon.
Heritage
Boyle-Marriott zakon smatra da je pritisak na plin u izotermnom procesu proporcionalan zauzetom plinu. Kada shvatimo da je i snaga gasa proporcionalna zapremini koju vino zauzima, onda ćemo doći do zaključka:
β T = 1 str. (\displaystyle \beta _(T)=(\frac (1)(p)).)Tokom izotermnog procesa, pritisak na gas se menja direktno proporcionalno njegovoj debljini.
Na ovaj način dolazimo do vrha:
Izotermički koeficijent fluidnosti idealnog plina jednak je vrijednosti okretanja njegovog škripca.
Div. takođe
Bilješke
- Petrushevsky F. F.// Enciklopedijski rječnik Brockhausa i Efrona: u 86 tomova (82 sveska i 4 dodatka). - St. Petersburg. , 1890-1907.
Razlika između parametara koji karakterišu proces date mase gasa, jasna je iz promene gasnih procesa koji se odvijaju usled nepromenljivosti jednog od parametara. Englesko čitanje Boyle(1.669 RUR) i francuska verzija Marriott(1676 r.) uveo je zakon koji izražava važnost promjene tlaka prije promjene dovoda plina na konstantnoj temperaturi. Sprovešćemo uvredljivu istragu.
Oblozi ručke su promjenjivo premazani plinom (ponovno) u cilindru A (Sl. 11, a). Obratite pažnju na očitavanja manometra i promjene tlaka na plinu. Promijenite tlak plina u posudi (temperatura je naznačena na skali B) i, bilježeći pritisak, zapišite ih u tablicu. 1. Iz njega je jasno da je opskrba plinom za ovaj pritisak mnogo konstantnija: koliko se puta promijenila opskrba plinom, toliko se i pritisak povećao.

Kao rezultat sličnih, preciznijih istraživanja, otkriveno je: za datu masu gasa na konstantnoj temperaturi, pritisak na gas se menja proporcionalno promeni pritiska na gas. Ovo je formulacija Boyle-Marriottovog zakona. Matematički, vrijednost za dva stupnja može se napisati na sljedeći način:
![]()
Proces pretvaranja gasa u konstantnu temperaturu naziva se izotermni. Formula za Boyle-Marriott zakon jednaka je izotermnom stanju gasa. Na stalnoj temperaturi, prosječna fluidnost molekula se ne mijenja. Promjena u opskrbi plinom rezultira promjenom broja udara molekula na zidove posude. To je razlog za promjenu pritiska na plin.
Ovaj proces je grafički zamisliv, na primjer, za svaki slučaj V = 12 l, p = 1 at.. Zapremina gasa je prikazana na apscisnoj osi, a zapremina gasa je prikazana na osi ordinata (slika 11, b). Znamo tačke koje označavaju vrijednost V i p za kožni par i, povezujući ih jedno s drugim, možemo nacrtati graf izotermnog procesa. Linija koja predstavlja količinu prostora između zapremine i pritiska gasa. Pri konstantnoj temperaturi naziva se izoterma. U čistom obliku, izotermni procesi se ne ubrzavaju. Česti su kvarovi kada se temperatura gasa malo mijenja, na primjer, kada se zrak upumpava u cilindre kompresorom, kada se mješavina goriva unosi u cilindar motora s unutrašnjim sagorijevanjem. U takvim epizodama degeneracije, pritisak na gas se mora izvršiti u skladu sa Boyle-Marriott zakonom*.