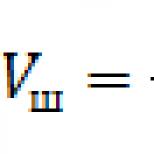Закон Бойля-Маріотта. Газові закони Ізотерма. Дихання закон Бойля – Маріотта Закон бойля маріотта різні формулювання
Перейдемо тепер до докладнішого вивчення питання, як змінюється тиск певної маси газу, якщо температура його залишається незмінною і змінюється лише обсяг газу. Ми вже з'ясували, що такий ізотермічнийпроцес здійснюється за умови сталості температури тіл, що оточують газ, і настільки повільної зміни обсягу газу, що температура газу будь-якої миті процесу не відрізняється від температури навколишніх тіл. Ми ставимо таким чином питання: як пов'язані між собою обсяг і тиск при ізотермічній зміні стану газу? Щоденний досвід вчить нас, що при зменшенні обсягу деякої маси газу, тиск його збільшується. Як приклад, можна вказати підвищення пружності при накачуванні футбольного м'яча, велосипедної або автомобільної шини. Постає питання: як саме збільшується тиск газу при зменшенні обсягу, якщо температура газу залишається незмінною?
Відповідь це питання дали дослідження, зроблені XVII столітті англійським фізиком і хіміком Робертом Бойлем (1627-1691) і французьким фізиком Едемом Маріоттом (1620-1684).
Досліди, що встановлюють залежність між об'ємом та тиском газу, можна відтворити: на вертикальній стійці , забезпеченої поділами, знаходяться скляні трубки Аі В,з'єднані гумовою трубкою С. У трубки налита ртуть. Трубка зверху відкрита, на трубці А є кран. Закриємо цей кран, замкнувши таким чином деяку масу повітря у трубці А.Поки ми не зсуваємо трубок, рівень ртуті в обох трубках однаковий. Це означає, що тиск повітря, замкненого в трубці А,таке ж, як і тиск навколишнього повітря.
Тепер повільно підніматимемо трубку У. Ми побачимо, що ртуть в обох трубках підніматиметься, але не однаково: у трубці Урівень ртуті буде весь час вищий, ніж у А. Якщо ж опустити трубку В, то рівень ртуті в обох колінах знижується, але в трубці Узниження більше, ніж у А.Об'єм повітря, замкненого в трубці А,можна відрахувати за поділками трубки А.Тиск цього повітря відрізнятиметься від атмосферного на величину тиску стовпа ртуті, висота якого дорівнює різниці рівнів ртуті в трубках А і В. При. підняття трубки Утиск стовпа ртуті додається до атмосферного тиску. Об'єм повітря в А при цьому зменшується. При опусканні трубки Урівень ртуті у ній виявляється нижче, ніж у А, і тиск стовпа ртуті віднімається з атмосферного тиску; об'єм повітря в А
відповідно збільшується. Зіставляючи отримані таким чином значення тиску і об'єму повітря, замкненого в трубці А, переконаємося, що при збільшенні об'єму деякої маси повітря в кілька разів тиск його в стільки ж разів зменшується, і навпаки. Температуру повітря в трубці за наших дослідів можна вважати незмінною. Подібні ж досліди можна зробити і з іншими газами. Результати виходять такі ж. Отже,
тиск деякої маси газу при незмінній температурі обернено пропорційно обсягу газу (закон Бойля-Маріотта).Для розріджених газів закон Бойля – Маріотта виконується з високим ступенем
точності. Для газів сильно стислих або охолоджених виявляються помітні відступи від цього закону. Формула, що виражає закон Бойля – Маріотта.
Дослідження великого англійського вченого Бойля започаткували народження нової хімічної науки. Він виділив хімію в самостійну науку і показав, що має свої проблеми, свої завдання, які треба вирішувати своїми методами, відмінними від медицини. Систематизуючи численні кольорові реакції та реакції осадження, Бойль започаткував аналітичну хімію. Він же став автором одного з перших законів фізико-хімічної науки, що народжується.
Роберт Бойль (1627—1691) був тринадцятою дитиною з чотирнадцяти дітей Річарда Бойля — першого герцога Коркського, лютого й удачливого користолюбця, який жив у часи королеви Єлизавети і помножив свої угіддя захопленням чужих земель. Він народився в Лісморі Каслі, одному з ірландських маєтків батька. Там Роберт провів своє дитинство. Він здобув чудову домашню освіту і у віці восьми років став студентом Ітонського університету. Там він провчився чотири роки, після чого поїхав у новий маєток батька - Столбрідж.
Як було прийнято на той час, у віці дванадцяти років Роберта разом із братом відправили у подорож Європою. Він вирішив продовжити освіту у Швейцарії та Італії та пробув там довгі шість років. В Англію Бойль повернувся лише 1644 року, вже після смерті батька, який залишив йому значний стан.
У Столбріджі він влаштував лабораторію, де до кінця 1645 розпочав дослідження з фізики, хімії та агрохімії. Бойль любив працювати одночасно з кількох проблем. Зазвичай він докладно роз'яснював помічникам, що доведеться зробити за день, а потім віддалявся до кабінету, де на нього чекав секретар. Там він диктував свої філософські трактати.
Вчений-енциклопедист, Бойль, займаючись проблемами біології, медицини, фізики та хімії, виявляв не менший інтерес до філософії, теології та мовознавства. Бойль надавав першорядного значення лабораторним дослідженням. Найбільш цікавими та різноманітними були його досліди з хімії. Він вважав, що хімія, відбрунівшись від алхімії та медицини, цілком може стати самостійною наукою.
Спочатку Бойль зайнявся отриманням настоїв із квітів, цілющих трав, лишайників, деревної кори та коріння рослин. Найцікавішим виявився фіолетовий настій, отриманий із лакмусового лишайника. Кислоти змінювали його колір на червоний, а луги на синій. Бойль розпорядився просочити цим настоєм папір і потім висушити його. Клаптик такого паперу, занурений у випробуваний розчин, змінював свій колір і показував, чи кислий розчин, чи лужний. Це була одна з перших речовин, які вже тоді Бойль назвав індикаторами.
Спостережний учений було пройти повз ще одну властивість розчинів: коли до розчину срібла в азотної кислоті додавали трохи соляної кислоти, утворювався білий осад, який Бойль назвав «місяць корнеа» (хлорид срібла). Якщо цей осад залишали у відкритій посудині, він чорнів. Це була аналітична реакція, що достовірно показує, що в досліджуваній речовині міститься «місяць» (срібло).
Молодий вчений продовжував сумніватися в універсальній аналітичній здатності вогню та шукав інші засоби для аналізу. Його багаторічні дослідження показали, що коли на речовини діють тими чи іншими реактивами, вони можуть розкладатися на простіші сполуки. Використовуючи специфічні реакції, можна було визначати ці сполуки. Одні речовини утворювали забарвлені опади, інші виділяли газ із характерним запахом, треті давали забарвлені розчини тощо. Процеси розкладання речовин та ідентифікацію отриманих продуктів за допомогою характерних реакцій Бойль назвав аналізом. Це був новий метод роботи, який дав поштовх розвитку аналітичної хімії.
1654 року вчений переселився в Оксфорд, де продовжив свої експерименти разом з асистентом Вільгельмом Гомбергом. Дослідження зводилися до однієї мети: систематизувати речовини та розділити їх на групи відповідно до їх властивостей.
Після Гомберга його помічником став молодий фізик Роберт Гук. Вони присвятили свої дослідження переважно газам та розвитку корпускулярної теорії.
Дізнавшись із наукових публікацій про роботи німецького фізика Отто Геріке, Бойль вирішив повторити його експерименти і для цієї мети винайшов оригінальну конструкцію повітряного насоса. Перший зразок цієї машини було збудовано за допомогою Гука. Дослідникам вдалося майже повністю видалити повітря насосом. Проте всі спроби довести присутність ефіру в порожній посудині були марними.
— Жодного ефіру не існує, — зробив висновок Бойль. Порожній простір він вирішив назвати вакуумом, що латиною означає «порожній».
1660 року у своєму маєтку Бойль завершив свою першу велику наукову роботу — «Нові фізико-механічні експерименти щодо ваги повітря та його прояви». Наступною стала книга "Хімік - скептик". У цих книгах Бойль каменя на камені не залишив від вчення Аристотеля про чотири елементи, що існував майже
дві тисячі років, Декартова «ефіру» та трьох алхімічних почав. Звичайно, ця праця викликала різкі нападки з боку послідовників Аристотеля та картезіанців. Проте Бойль спирався у ньому досвід, і тому докази його були незаперечні. Більшість учених — послідовники корпускулярної теорії — із захопленням сприйняли ідеї Бойля. Багато його ідейних противників теж змушені були визнати відкриття вченого.
Новим асистентом у нього в лабораторії Оксфорда стає молодий фізик Річард Таунлі. Разом з ним Бойль відкрив один із фундаментальних фізичних законів, встановивши, що зміна обсягу газу обернено пропорційно зміні тиску. Це означало, що, знаючи зміну обсягу судини, можна було точно визначити зміни тиску газу. Це відкриття стало найбільшим відкриттям XVII ст. Бойль вперше описав його у 1662 році («На захист вчення щодо еластичності та ваги повітря») і скромно назвав гіпотезою.
Поняття пружності повітря, що відповідає нинішньому поняттю тиску, було визначальним у задумах та здійсненні дослідів Бойля.
«Пружність повітря, - пише Льоцци, - була продемонстрована Паскалем у досвіді, повтореному Академією дослідів та Геріці. Бульбашка з повітрям роздмухується, якщо його помістити в барометричну камеру або в резервуар, з якого відкачано повітря. Досвід Геріке з двома сполученими судинами також свідчив про пружність повітря». Зауважимо до речі, що з описаних дослідів із повітрям народилася теорія пружності. Цей термін, запроваджений Пекке в 1651 року, широко застосовувався Бойлем, який також зробив перші дослідження пружності твердих тіл.
Проти такого розуміння ополчився Франческо Ліно (1595-1675), який по суті відстоював ідеї, висунуті Фабрі, а також Мерсенном, які намагалися приписати ефект Торрічеллі і всмоктування води насосом зчеплення «гачкуватих» частинок води і повітря, що стикаються один з одним. У своїй роботі «Про експеримент із ртуттю у скляних трубках...», опублікованій у 1660 році, Ліно зауважує, що якщо опустити в ртуть трубку, відкриту з обох кінців, а потім прикрити верхній кінець пальцем і частково витягнути трубку з ртуті, то відчувається, що подушечка пальця втягується всередину трубки. Це тяжіння, міркує далі Ліно, свідчить не про зовнішній атмосферний тиск, а про внутрішню силу, обумовлену невидимими нитками («фунікулами») матеріальної субстанції, прикріпленими одним кінцем до пальця, а іншим до стовпа ртуті.
Зараз такі ідеї викликають лише усмішку, але тоді вони потребували серйозного розгляду, що й зробив Бойль у своїй роботі «Захист проти Ліно», де ставить собі за мету довести, що пружність повітря здатна на більше, ніж просте утримання торрічеллієвого стовпа».
Бойль докладно описує своє дослідження: «Ми взяли довгу скляну трубку, яка майстерною рукою за допомогою лампи була вигнута таким чином, що зігнута вгору частина була майже паралельна решті. Отвір у цьому коротшому коліні... було герметично запаяно. Коротке коліно по всій своїй довжині поділено на дюйми (кожен з яких поділений на вісім частин) за допомогою смужки паперу з нанесеними на ній поділками, яка була акуратно приклеєна до трубки». Така сама смужка паперу була приклеєна до довгого коліна. Потім у трубку була налита «ртуть у такій кількості, щоб вона заповнила напівкруглу або вигнуту частину сифона» і стояла на тому самому рівні в обох колінах. «Коли це було зроблено, ми почали доливати ртуть у довге коліно... поки повітря в короткому коліні не виявилося зменшеним завдяки стиску так, що він зайняв лише половину первинного об'єму... Ми не зводили очей з довшого коліна трубки... і ми помітили, що ртуть у цьому довшому коліні трубки стояла на 29 дюймів вище, ніж в іншому».
Підбиваючи підсумки цим експериментам, Бойль зазначив: «Коли повітря було стиснуте настільки, що воно було згущене в об'ємі, що складало одну чверть початкового, ми спробували, наскільки холод від льняної тканини, змоченої водою, згущує повітря. І часом здавалося, що повітря дещо стискається, проте не настільки, щоб на цьому можна було робити якісь висновки. Потім ми також спробували, чи жар... розширюватиме повітря; при наближенні полум'я свічки до тієї частини, де було укладено повітря, виявилося, що теплота має більш помітну дію, ніж раніше холод».
Цікаво, що висновки з досліджень зробив не Бойль, а Таунлі. Бойль вказує, що Річард Таунлі, читаючи перше видання його твору "Нові фізико-механічні експерименти щодо пружності повітря" висловив гіпотезу, що "тиск і протяги назад пропорційні один одному".
Я.Г. Дорфман пише: «П'ятнадцять років після опублікування цих досліджень Бойлем, тобто в 1679, у Франції з'явилася «Мова про природу повітря» абата Едма Маріотта, в якій поряд з іншими питаннями описувалися аналогічні експериментам Бойля досліди з вивчення залежності між тиском повітря та займаним обсягом. Маріотт ні словом не згадує про свого попередника, ніби йому зовсім невідомі роботи Бойля з пневматики. Тим часом роботи Бойля були широко відомі: вони публікувалися латинською та англійською мовами. Втім, Маріотт не вперше забув згадати свого попередника, адже точно так само в 1673 в праці про зіткнення він ні словом не сказав про роботу Гюйгенса, запозичивши у останнього не тільки методику експерименту, а й основи теорії.
Робота Маріотта значно поступається роботі Бойля щодо ретельності експерименту. Бойль, як ми бачили, вимірює висоти ртутного стовпа з точністю до шістнадцятих часток дюйма, зіставляє реально спостерігаються значення з обчисленнями і свідчить про неминучу похибка у вимірах. Маріотт вимірює висоти ртутного стовпа в цілих дюймах і обмежується повідомленням, що дослідні дані строго узгоджуються з розрахунковими. Обережний і критично налаштований, Бойль називає відкритий ним закон лише «гіпотезою», яка потребує експериментального підтвердження. Маріотт проголошує його законом чи правилом природи. Так що по справедливості «закон Бойля-Маріотта» має іменуватися «законом Бойля-Таунлі» або «Бойля-Таунлі-Гука». На жаль, іноді в курсах фізики помилково стверджується, ніби Маріотт «уточнив» дослідження Бойля, що не відповідає дійсності».
Проте саме Маріотт (1620-1684) передбачив різні застосування закону. З них найважливішим був розрахунок висоти місця за даними барометра. Розрахунок, що проводився шляхом оперування з нескінченно малими величинами, призвів до невдачі внаслідок слабкої математичної підготовки вченого.
Пізніше в 1686 до проблеми визначення висоти по атмосферному тиску звернувся англійський астроном Едмонд Галлей (1656 - 1742). Він відомий більшості читачів по відкритій їм кометі, що носить його ім'я. Так ось, Галлей знайшов формулу, по суті, правильну, якщо не враховувати зміни температури. Суть формули Галлея зводилася до твердження, що зі зростанням висоти в арифметичній прогресії атмосферний тиск зменшується в геометричній прогресії.
Як ми дихаємо?
Об'єм повітря між легеневими бульбашками та зовнішнім середовищем здійснюється в результаті ритмічних дихальних рухів грудної клітки. При вдиху об'єм грудної клітки та легень збільшується, при цьому тиск у них знижується і повітря через повітроносні шляхи (ніс, горло) входить у легеневі бульбашки. При виході об'єм грудної клітини та легень зменшується, тиск у легеневих бульбашках підвищується і повітря з надлишковим вмістом оксиду вуглецю (вуглекислого газу) виходить із легенів назовні. Тут застосовується закон Бойля-Маріотта, тобто залежність тиску від обсягу.
Чи довго ми зможемо не дихати? Навіть треновані люди можуть затримувати дихання на 3-4 та навіть 6 хвилин, але не довше. Більше тривале кисневе голодування може призвести до смерті. Тому кисень повинен надходити в організм постійно. Дихання – перенесення кисню із довкілля всередину організму.Основний орган дихальної системи
- Легкі, навколо яких є плевральна рідина.
Застосування закону Бойля-Маріотта
Газові закони активно працюють у техніці, а й у живої природі, широко застосовують у медицині.
Закон Бойля-Маріотта починає «працювати на людину» (як і на будь-якого ссавець) з моменту його народження, з першого самостійного подиху.
При диханні міжреберні м'язи та діафрагма періодично змінюють об'єм грудної клітки. Коли грудна клітина розширюється, тиск повітря у легенях падає нижче за атмосферне, тобто. «спрацьовує» ізотермічний закон (pv=const), і внаслідок перепаду тисків, що утворився, відбувається вдих.
Дихання легеневе: дифузія газів у легенях
Для того щоб обмін шляхом дифузії був досить ефективним, обмінна поверхня повинна бути великою, а дифузійна відстань - маленькою. Дифузійний бар'єр у легенях повністю відповідає цим умовам. Загальна поверхня альвеол становить близько 50 – 80 кв. м. За своїми структурними особливостями тканина легень підходить для здійснення дифузії: кровлегеневих капілярів відокремлена від альвеолярного простору найтоншим шаром тканини. У процесі дифузії кисень проходить через альвеолярний епітелій, інтерстиціальний простір між основними мембранами, ендотелій капіляра, плазму крові, мембрану еритроциту та внутрішнє середовище еритроциту. Сумарна дифузна відстань становить близько 1 мкм.
Молекули вуглекислого газу дифундують тим самим шляхом, але у зворотному напрямку - від еритроциту до альвеолярного простору. Однак дифузія вуглекислого газу стає можливою лише після вивільнення його з хімічного зв'язку з іншими сполуками.
При проходженні еритроциту через легеневі капіляри час, протягом якого можлива дифузія (час контакту), відносно невелика (близько 0,3 с). Однак цього часу цілком достатньо для того, щоб напруга дихальних газів у крові та їхній парціальний тиск в альвеолах практично зрівнялися.
Досвід визначити дихальний об'єм та життєву ємність легень.
Ціль:визначити дихальний об'єм та життєву ємність легень.
Обладнання:повітряна кулька, вимірювальна стрічка.
Хід роботи :
Надує повітряна кулька, як можна сильніше за N (2) спокійних видихів.
Виміряємо кульки діаметр і розрахуємо його об'єм за формулою:
Де d-діаметр кулі.
Обчислимо дихальний обсяг своїх легень: , де N – числи видихів.
Надуємо кульку ще двічі і обчислимо середнє значення дихального об'єму своїх легень
![]()
![]()
![]()
Визначимо життєву ємність легень (ЖЕЛ) – найбільший об'єм повітря, який людина може видихнути після найглибшого вдиху. Для цього, не віднімаючи кульку від рота, зробимо глибокий вдих через ніс і максимальний видих через рот у кульку. Повторимо 2 рази. де N=2.
Робертом Бойлем і незалежно перевідкритий Едмом Маріоттом у 1676 році. Описує поведінку газу в ізотермічному процесі. З погляду сучасної фізики закон є наслідком рівняння Клапейрона - Менделєєва .Формулювання
Твердження закону Бойля - Маріотта полягає в наступному :
У математичній формі це твердження записується у вигляді формули
p V = C , (\displaystyle pV = C,)де p (\displaystyle p)- Тиск газу; V (\displaystyle V)- обсяг газу, а C (\displaystyle C)- Постійна в обумовлених умовах величина. У загальному випадку значення C (\displaystyle C)визначається хімічною природою, масою та температурою газу.
Очевидно, що якщо індексом 1 позначити величини, що належать до початкового стану газу, а індексом 2 - До кінцевого, то наведену формулу можна записати у вигляді
p 1 V 1 = p 2 V 2 (\displaystyle p_(1)V_(1)=p_(2)V_(2)).Зі сказаного і наведених формул випливає вигляд залежності тиску газу від його обсягу в ізотермічному процесі:
p = CV. (\displaystyle p=(\frac (C)(V)).)Ця залежність є інше, еквівалентне першому, вираз змісту закону Бойля - Маріотта. Вона означає, що
Тиск деякої маси газу, що знаходиться при постійній температурі, обернено пропорційно його обсягу.
Тоді зв'язок початкового та кінцевого станів газу, який брав участь в ізотермічному процесі, можна виразити у вигляді:
p 1 p 2 = V 2 V 1 . (\displaystyle (\frac (p_(1))(p_(2)))=(\frac (V_(2))(V_(1))).)Слід зазначити, що застосування цієї і наведеної вище формули, що зв'язує початкові і кінцеві тиски і об'єми газу один з одним, не обмежується випадком ізотермічних процесів. Формули залишаються справедливими й у випадках, коли під час процесу температура змінюється, але результаті процесу кінцева температура виявляється рівної початкової.
Важливо уточнити, що цей закон справедливий лише в тих випадках, коли цей газ можна вважати ідеальним. Зокрема, з високою точністю закон Бойля - Маріотта виконується стосовно розріджених газів. Якщо ж газ дуже стислий, то спостерігаються суттєві відступи від цього закону.
Наслідки
Закон Бойля - Маріотта стверджує, що тиск газу в ізотермічному процесі обернено пропорційно займаному газом. Якщо врахувати, що щільність газу також обернено пропорційна об'єму, який він займає, то ми прийдемо до висновку:
β T = 1 p. (\displaystyle \beta _(T)=(\frac (1)(p)).)При ізотермічному процесі тиск газу змінюється прямо пропорційно до його щільності.
Таким чином, приходимо до висновку:
Ізотермічний коефіцієнт стисливості ідеального газу дорівнює зворотній величині його тиску.
Див. також
Примітки
- Петрушевський Ф. Ф.// Енциклопедичний словник Брокгауза та Єфрона: в 86 т. (82 т. і 4 дод.). - СПб. , 1890-1907.
Вивчення залежності між параметрами, що характеризують стан даної маси газу, почнемо з вивчення газових процесів, що протікають за незмінності одного з параметрів. Англійський вчений Бойль(1669 р.) і французький вчений Маріотт(1676 р.) відкрили закон, який виражає залежність зміни тиску від зміни обсягу газу при постійній температурі. Проведемо наступний досвід.
Обертанням рукоятки змінюватимемо обсяг газу (повітря) в циліндрі А (рис. 11, а). За показанням манометра зауважимо, що і тиск газу при цьому змінюється. Змінюватимемо обсяг газу в посудині (обсяг визначається за шкалою В) і, помічаючи тиск, запишемо їх в табл. 1. З неї видно, що добуток обсягу газу на його тиск був майже постійним: у скільки разів "зменшувався обсяг газу, у стільки ж разів збільшувався його тиск.

В результаті подібних, більш точних дослідів було відкрито: для даної маси газу при постійній температурі тиск газу змінюється обернено пропорційно до зміни обсягу газу. Це і є формулювання закону Бойля-Маріотта. Математично він для двох станів запишеться так:
![]()
Процес зміни стану газу за постійної температури називається ізотермічним.Формула закону Бойля-Маріотта є рівнянням ізотермічного стану газу. За постійної температури середня швидкість руху молекул не змінюється. Зміна обсягу газу викликає зміну числа ударів молекул об стінки судини. Це і є причиною зміни тиску газу.
Зобразимо графічно цей процес, наприклад для випадку V = 12 л, р = 1 ат.. Відкладатимемо на осі абсцис об'єм газу, а на осі ординат - його тиск (рис. 11, б). Знайдемо точки, що відповідають кожній парі значень V і р, і, поєднавши їх між собою, отримаємо графік ізотермічного процесу. Лінія, що зображує залежність між об'ємом і тиском газу. При постійній температурі називається ізотермою. Ізотермічні процеси у чистому вигляді не зустрічаються. Але нерідкі випадки, коли температура газу мало змінюється, наприклад, при накачуванні компресором повітря в балони, при впуску горючої суміші в циліндр двигуна внутрішнього згоряння. У таких випадках розрахунки обсягу та тиску газу проводяться згідно із законом Бойля-Маріотта*.