Tri hemijske molekule ozona. Ozon, fizička i hemijska svojstva, primjena. Formiranje ozona u mikrotalasnom polju
DEFINICIJA
Ozon je alotropna modifikacija kiseonika. U svom normalnom stanju to je svijetloplavi plin, u tečnom je tamno plavi, a u čvrstom je tamno ljubičast (do crne boje).
Može ostati u rashlađenom tečnom stanju do temperature (-250 o C). slabo topiva u vodi, bolja je u tetrakloridu ugljiku i raznim fluorohloro ugljikovodicima. Vrlo jak oksidant.
Hemijska formula ozona
Hemijska formula ozona - O 3. Pokazuje da molekul ove tvari sadrži tri atoma kisika (Ar \u003d 16 amu). Hemijska formula se može koristiti za izračunavanje molekulske težine ozona:
Mr (O 3) \u003d 3 × Ar (O) \u003d 3 × 16 \u003d 48
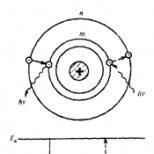
Strukturna (grafička) formula ozona
Ilustrativniji je strukturna (grafička) formula ozona... Pokazuje kako su atomi povezani međusobno unutar molekule (Sl. 1).
Slika: 1. Struktura molekula ozona.
Elektronska formula prikazuje raspodjelu elektrona u atomu po energetskim podravninama prikazano u nastavku:
16 O 1s 2 2s 2 2p 6 3s 2 3p 4
Pokazuje i da kisik od kojeg je sastavljen ozon pripada elementima p porodice, kao i broju valentnih elektrona - na vanjskoj energetskoj razini postoji 6 elektrona (3s 2 3p 4).
Primjeri rješavanja problema
PRIMER 1
| Zadatak | Maseni udio vodika u njegovom spoju sa silikonom je 12,5%. Izvedite empirijsku formulu spoja i izračunajte njegovu molarnu masu. |
| Odluka |
Izračunavamo masni udio silicijuma u spoju: ω (Si) \u003d 100% - ω (H) \u003d 100% - 12,5% \u003d 87,5% Označimo broj molova elemenata koji čine spoj brojevima "x" (silicij) i "y" (vodik). Tada će molarni omjer izgledati na sljedeći način (vrijednosti relativne atomske mase uzete iz periodične tablice D.I.Mendeleeva, zaokružene na cijele brojeve): x: y \u003d ω (Si) / Ar (Si): ω (H) / Ar (H); x: y \u003d 87,5 / 28: 12,5 / 1; x: y \u003d 3.125: 12.5 \u003d 1: 4 To znači da će formula za spoj silicijum-vodonika imati oblik SiH4. Ovo je silicijum hidrid. |
| Odgovor | SiH 4 |
PRIMER 2
| Zadatak | U spoju kalijuma, hlora i kiseonika masne udjele elemenata su, 31,8%, 29%, 39,2%. Uspostavite najjednostavniju formulu složenog spoja. |
| Odluka | Maseni udio elementa X u molekuli sastava HX izračunava se sljedećom formulom: ω (X) \u003d n × Ar (X) / M (HX) × 100% Označimo broj molova elemenata koji čine spoj brojevima "x" (kalijum), "y" (klor) i "z" (kisik). Tada će molarni omjer izgledati na sljedeći način (vrijednosti relativne atomske mase uzete iz periodične tablice D.I.Mendeleeva, zaokružene na cijele brojeve): x: y: z \u003d ω (K) / Ar (K): ω (Cl) / Ar (Cl): ω (O) / Ar (O); x: y: z \u003d 31,8 / 39: 29 / 35,5: 39,2 / 16; x: y: z \u003d 0,82: 0,82: 2,45 \u003d 1: 1: 3 To znači da će formula za spoj kalijuma, hlora i kiseonika imati oblik KClO3. Ovo je Bertholletova sol. |
| Odgovor | KClO 3 |
1785. nizozemski fizičar Van Marum, izvodeći eksperimente sa strujom, skrenuo je pažnju na miris kada se u električnom stroju stvaraju iskre i na oksidacijsku sposobnost zraka nakon što kroz njega prođu električne iskre.
1840. njemački naučnik Scheinbein, koji se bavio hidrolizom vode, pokušao je razgraditi to u kisik i vodik pomoću električnog luka. A onda je otkrio da se formira novi, do sada nepoznati nauci, plin specifičnog mirisa. Naziv "ozon" Scheinbein je plinu dao zbog svog karakterističnog mirisa i dolazi od grčke riječi "ozien", što znači "mirisati".
1857. godine uz pomoć „savršene magnetske indukcijske cijevi“ koju je stvorio Werner von Siemens, izgrađena je prva tehnička postrojenje za ozon. 1901. godine Siemens je izgradio prvu hidroelektranu s postrojenjem za ozon u Wiesbandu.
Povijesno gledano, upotreba ozona započela je instalacijama za pripremu vode za piće, kad je 1898. godine u gradu Saint Mor (Francuska) testirana prva pilotska postrojenja. Već 1907, u gradu Beaune Vuayage (Francuska), za potrebe grada Nice, izgrađeno je prvo postrojenje za ozoniranje vode. 1911. u Sankt Peterburgu puštena u rad stanica za ozoniranje pitke vode (trenutno ne radi). 1916. godine već je bilo u funkciji 49 postrojenja za ozonizaciju pitke vode.
Do 1977. više od 1000 instalacija je radilo širom svijeta. Ozon je postao široko rasprostranjen tek u zadnjih 30 godina, zahvaljujući pojavi pouzdanih i kompaktnih uređaja za njegovu sintezu - ozonatori (generatori ozona).
Trenutno je 95% vode za piće u Evropi obrađeno ozonom. SAD je u procesu prelaska sa kloriranja u ozoniranje. Nekoliko velikih stanica djeluje u Rusiji (u Moskvi, Nižnjem Novgorodu i drugim gradovima).
2. Ozon i njegova svojstva
Mehanizam nastanka i molekularna formula ozona
Poznato je da se molekula kisika sastoji od 2 atoma: O2. Pod određenim uvjetima, molekula kisika može disocirati, tj. raspadaju se u 2 odvojena atoma. U prirodi su ti uslovi stvoreni za vrijeme grmljavinske oluje sa ispuštanjem atmosferske struje, a u gornjoj atmosferi pod utjecajem ultraljubičastoga zračenja sunca (ozonski omotač Zemlje). Mehanizam formiranja i molekularna formula ozona. Međutim, atom kiseonika ne može postojati odvojeno i ima tendenciju ponovo grupirati. U toku ovog preuređenja formiraju se 3-atomski molekuli.
Ozonska molekula Molekul koji se sastoji od 3 atoma kisika, nazvan ozonom ili aktiviranim kisikom, alotropna je modifikacija kisika i ima molekulsku formulu O3 (d \u003d 1,28 A, q \u003d 116,5 °).
Treba napomenuti da je veza trećeg atoma u molekuli ozona relativno krhka, što uzrokuje nestabilnost molekula u cjelini i njegovu sklonost samo-propadanju.

Ozonska svojstva
 Ozon O3 je plavkast plin karakterističnog oštrog mirisa, molekulske mase 48 g / mol; gustoća u odnosu na zrak 1.657 (ozon je teži od zraka); gustoća pri 00S i pritisak 0,1 MPa 2.143 kg / m3. Proizvodnja ozona
Ozon O3 je plavkast plin karakterističnog oštrog mirisa, molekulske mase 48 g / mol; gustoća u odnosu na zrak 1.657 (ozon je teži od zraka); gustoća pri 00S i pritisak 0,1 MPa 2.143 kg / m3. Proizvodnja ozona
U malim koncentracijama na razini od 0,01-0,02 mg / m3 (pet puta niže od maksimalne dopuštene koncentracije za ljude), ozon daje zraku karakterističan miris svježine i čistoće. Na primjer, nakon grmljavinske oluje suptilni miris ozona neprestano je povezan s čistim zrakom.
Kao što je gore spomenuto, molekul ozona je nestabilan i samopropada. Zbog ovog svojstva je ozon snažno oksidacijsko sredstvo i dezinfekcijsko sredstvo izuzetne efikasnosti.
Oksidirajući potencijal ozona
Mjera efikasnosti oksidansa je njegov elektrohemijski (oksidativni) potencijal, izražen u voltima. Ispod su vrijednosti elektrohemijskog potencijala različitih oksidansa u usporedbi s ozonom:
| Oksidirajuće sredstvo | Potencijal, V | % Ozonskog potencijala | Primjena oksidansa u obradi vode |
| Fluor (F2) | 2,87 | 139 | — |
| Ozon (O3) | 2,07 | 100 | + |
| Vodikov peroksid (H2O2) | 1,78 | 86 | + |
| Kalijev permanganat (KMnO4) | 1,7 | 82 | + |
| Hipobromna kiselina (HOBr) | 1,59 | 77 | + |
| Hipolorična kiselina (HOCl) | 1,49 | 72 | + |
| Klor (Cl2) | 1,36 | 66 | + |
| Hlor-dioksid (ClO2) | 1,27 | 61 | + |
| Kisik (O2) | 1,23 | 59 | + |
| Hromna kiselina (H2CrO2) | 1,21 | 58 | — |
| Brom (Br2) | 1,09 | 53 | + |
| Dušična kiselina (HNO3) | 0,94 | 45 | — |
| Jod (I2) | 0,54 | 26 | — |
Tabela pokazuje da je ozon najjači od svih oksidansa koji se koriste u tretmanu vode.
Aplikacija na licu mjesta
Nestabilnost ozona čini ga potrebnim za njegovo korištenje izravno na mjestu proizvodnje. Ozon ne podliježe pakiranju, skladištenju i prijevozu.
Rastvorljivost ozona u vodi
Prema Henryjevom zakonu, koncentracija ozona u vodi raste s koncentracijom ozona u plinskoj fazi pomiješanoj u vodi. Pored toga, što je viša temperatura vode, niža je koncentracija ozona u vodi.
Topivost ozona u vodi veća je od kiseonika, ali niža od hlora, 12 puta. Ako uzmemo u obzir 100% ozon, tada je njegova maksimalna koncentracija u vodi 570 mg / l pri temperaturi vode od 20 ° C. Koncentracija ozona u gasu na izlazu savremenih postrojenja za ozoniranje doseže 14% po masi. Ispod je ovisnost koncentracije ozona otopljenog u destiliranoj vodi o koncentraciji ozona u plinu i temperaturi vode.
| Koncentracija ozona u gasnoj smeši | Rastvorljivost ozona u vodi, mg / l | |||
| 7 ° C | 0 ° C | 18 ° C | 18 ° C | |
| 1.5% | 11.09 | 9.75 | 8.40 | 6.43 |
| 2% | 14.79 | 13.00 | 11.19 | 8.57 |
| 3% | 22.18 | 19.50 | 16.79 | 12.86 |
Samopropadanje ozona u vodi i zraku
Brzina raspada ozona u zraku ili vodi procjenjuje se uporabom poluživota, tj. vrijeme tokom kojeg je koncentracija ozona prepolovljena.
Samorazgradnju ozona u vodi (pH 7)
| Temperatura vode, ° S | Pola života |
| 15 | 30 minuta |
| 20 | 20 minuta |
| 25 | 15 minuta |
| 30 | 12 minuta |
| 35 | 8 minuta |
Samopropadanje ozona u zraku
| Temperatura vazduha, ° C | Pola života |
| -50 | 3 mjeseca |
| -35 | 18 dana |
| -25 | 8 dana |
| 20 | 3 dana |
| 120 | 1,5 sata |
| 250 | 1,5 sekundi |
Tablice pokazuju da su vodene otopine ozona mnogo manje stabilne od plinovitog ozona. Podaci o razgradnji ozona u vodi daju se za čistu vodu koja ne sadrži rastvorene i suspendirane nečistoće. Stopa raspada ozona u vodi povećava se više puta u sljedećim slučajevima:
1. ako u vodi postoje nečistoće oksidirane ozona (hemijska potreba za vodom u ozonu)
2. s povećanom zamućenošću vode, jer na granici između čestica i vode, reakcije samopropadanja ozona odvijaju se brže (kataliza)
3.koji su izloženi UV zračenju
3. Metode za proizvodnju ozona
Trenutno se široko koriste 2 metode proizvodnje ozona:
* UV zračenje
* pod utjecajem tihog (tj. raspršenog, iskrećeg) koronskog pražnjenja
1.UV zračenje
Ozon se može stvoriti u blizini UV žarulja, ali samo u malim koncentracijama (0,1 mas.%).

2.Korona pražnjenje
Na isti način na koji se ozon stvara električnim pražnjenjem za vrijeme grmljavinske oluje, velike količine ozona nastaju u modernim električnim generatorima ozona. Ova metoda se naziva koronski iscjedak. Visok napon prolazi kroz struju gasa koja sadrži kiseonik. Energija visokog napona deli molekulu kisika O2 na 2 O atome, koji se kombiniraju s molekulom O2 i tvore ozon O3.
Čisti kisik koji ulazi u generator ozona može se zamijeniti sa okolnim zrakom koji sadrži visoki postotak kisika.
Ovom metodom povećava se sadržaj ozona na 10-15 mas.%
Potrošnja energije: 20 - 30 W / g O3 za zrak 10 - 15 W / g O3 za kisik

4. Primjena ozona za pročišćavanje i dezinfekciju vode
Dezinfekcija vode
Ozon uništava sve poznate mikroorganizme: bakterije, viruse, protozoe, njihove spore, ciste itd .; istovremeno je ozon 51% jači od klora i djeluje 15-20 puta brže. Virus poliomijelitis umre pri koncentraciji ozona od 0,45 mg / l za 2 minute, a od hlora - samo za 3 sata pri 1 mg / l.
Ozon djeluje na spore oblike bakterija 300-600 puta jače od hlora.
Ozon uništava redox sustav bakterija i njihovu protoplazmu.
Biološki smrtonosni koeficijenti (BLK *) kod upotrebe različitih dezinfekcijskih sredstava
| Dezinfekcijsko sredstvo | Enterobacteriaceae | Virusi | Kontroverze | Ciste |
| Ozon O3 | 500 | 5 | 2 | 0.5 |
| Hipohlorna kiselina HOCl | 20 | 1 | 0.05 | 0.05 |
| Hipoklorit OCl- | 0.2 | <0.02 | <0.0005 | 0.0005 |
| Hloramin NH2Cl | 0.1 | 0.0005 | 0.001 | 0.02 |
* Što je BLK veći, to je snažnije dezinfekcijsko sredstvo
Usporedba dezinfekcijskih sredstava
| OZONE | UV | HLORIN | |
| E. coli | Da | Da | Da |
| Salmonela | Da | Da | Da |
| Giardia | Da | Da | Da |
| Legionnaire | Da | Ne | Ne |
| Crypto-sporidium | Da | Ne | Ne |
| Virus | Da | Ne | Ne |
| Mikroalge | Da | Ne | Ne |
| Rizik formiranja trihalometana | Ne | Ne | Da |
Deodorizacija vode
Ozoniranje oksidira organske i mineralne nečistoće koje su izvor mirisa i ukusa. Voda tretirana ozonom sadrži više kisika i ima ukus poput svježe izvorske vode.
Završni tretman pitke vode na linijama za flaširanje
Ozoniranje na liniji za punjenje. Pročišćena i pripremljena za flaširanje voda je zasićena ozonom, potpuno dezinficirana i relativno kratko vrijeme  stječe dezinfekcijska svojstva. Time se povećava mikrobiološka sigurnost postupka punjenja, ozonizirana voda pouzdano sterilizira zidove spremnika, plutu i zračni otvor ispod plute. Rok trajanja vode nakon ozoniranja uvećava se više puta. Kombinovana obrada vode ozonom u kombinaciji sa ispiranjem spremnika je posebno efikasna.
stječe dezinfekcijska svojstva. Time se povećava mikrobiološka sigurnost postupka punjenja, ozonizirana voda pouzdano sterilizira zidove spremnika, plutu i zračni otvor ispod plute. Rok trajanja vode nakon ozoniranja uvećava se više puta. Kombinovana obrada vode ozonom u kombinaciji sa ispiranjem spremnika je posebno efikasna.
Oksidacija gvožđa, mangana, sumporovodika
Gvožđe, mangan i hidrogen sulfid lako se oksidiraju ozonom. Ovo pretvara željezo u nerastvorljivi hidroksid, koji se lako zadržava u filterima. Mangan se oksidira u permanganatni ion, koji se lako uklanja na ugljičnim filterima. Vodonik-sulfid, sulfidi i hidrosulfidi pretvaraju se u bezopasne sulfate. Proces oksidacije i stvaranje filtrabilnih sedimenata tijekom ozoniranja odvija se u prosjeku 250 puta brže nego tijekom aeracije. Upotreba ozona je posebno efikasna za odleđivanje voda koja sadrži gvožđe-organske komplekse i bakterijske oblike željeza, mangana i hidrogen sulfida.
Obrada površinske vode od antropogenih nečistoća
Ozoniranje prethodno pročišćene vode praćeno filtracijom kroz aktivni ugalj pouzdan je način pročišćavanja površinske vode od fenola, naftnih proizvoda, pesticida i teških metala (oksidativni tretman sorpcije).
Pročišćavanje i dezinfekcija vode u peradi i farmama
 Ozoniranje na peradarskoj farmi. Opskrba vodom dekontaminiranom vodom za zdjelu za perad i životinje ne samo da pomaže u smanjenju incidencije i rizika od velikih epidemija, već uzrokuje ubrzani porast kilograma kod ptica i životinja.
Ozoniranje na peradarskoj farmi. Opskrba vodom dekontaminiranom vodom za zdjelu za perad i životinje ne samo da pomaže u smanjenju incidencije i rizika od velikih epidemija, već uzrokuje ubrzani porast kilograma kod ptica i životinja.
Pročišćavanje i dezinfekcija otpadnih voda
Uz pomoć ozona, otpadne vode se uklanjaju.
Uz pomoć ozoniranja otpadne vode mogu se uskladiti s strogim zahtjevima u ribarskim rezervoarima za sadržaj fenola, naftnih proizvoda i površinski aktivnih tvari, kao i mikrobiološkim pokazateljima.
Ozoniranje vode za dezinfekciju proizvoda i opreme
 Kao što je gore spomenuto, rok trajanja ozonirane vode tijekom postupka flaširanja značajno se povećava zbog činjenice da voda u proizvodu stječe svojstva dezinficijensne otopine.
Kao što je gore spomenuto, rok trajanja ozonirane vode tijekom postupka flaširanja značajno se povećava zbog činjenice da voda u proizvodu stječe svojstva dezinficijensne otopine.
Tijekom prerade hrane bakterije rastu na kontaminiranoj opremi, što je izvor jakih truleži i propadanja mirisa. Ispiranje opreme ozoniranom vodom nakon uklanjanja većine kontaminanata dovodi do površinske dezinfekcije, osvježavajućeg učinka na sobni zrak i poboljšanja općeg sanitarno-higijenskog stanja proizvodnje.
Ozoniranje za saniranje. Za razliku od ozoniranja vode prije punjenja, u vodi za čišćenje sredstava stvara se veća koncentracija ozona.
Riba i morski plodovi, trupovi peradi i povrće mogu se prije pakiranja preraditi slično ozoniziranoj vodi. Životni vijek proizvoda obrađenih prije skladištenja se povećava, a njihov izgled nakon skladištenja ne razlikuje se puno od svježih proizvoda.
5. Sigurnosni aspekti rada opreme za ozon
Gas ozona je toksičan i može izazvati opekotine i trovanja gornjih dišnih puteva (kao i bilo koji drugi jaki oksidans).
Najveća dopuštena koncentracija (MPC) ozona u zraku radnog područja regulirana je GOST 12.1.005 „Opći sanitarno-higijenski zahtjevi za zrak radnog područja“, prema kojoj je 0,1 mg / m3.
Miris ozona evidentira osoba u koncentraciji 0,01-0,02 mg / m3, što je 5-10 puta manje od MPC, dakle, pojava slabog mirisa ozona u sobi nije signalni alarm. Da bi se osiguralo pouzdano praćenje sadržaja ozona u proizvodnom području, potrebno je ugraditi analizatore plina koji omogućuju nadzor koncentracije ozona i, ako je premašena najveća dopuštena koncentracija, pravodobno poduzimati mjere za njegovo smanjivanje na siguran nivo.
Svaka tehnološka shema koja sadrži ozonsku opremu mora biti opremljena separatorom plina, uz pomoć kojeg višak (ne rastvorenog) ozona ulazi u katalitički razarač, gdje se razgrađuje na kisik. Takav sustav eliminira ispuštanje ozona u zrak proizvodne prostorije.
Jer ozon je najjače oksidirajuće sredstvo; svi gasovodi moraju biti izrađeni od materijala otpornih na ozon kao što su nehrđajući čelik i fluoroplastika.
Ozon je prvi put dobio i proučio Schönbein 1840. Ozon je plavkast plin, oštrog karakterističnog mirisa;
Tečni ozon je tamnoplava tečnost, čvrsti ozon je tamno ljubičasta kristalna masa. Ozon je rastvorljiv u tetrahloridu ugljiku, glacijalnoj sirćetnoj kiselini, tečnom azotu i vodi. Nastaje propuštanjem tihog električnog pražnjenja kroz zrak ili kisik (svjež miris nakon grmljavinske oluje nastaje zbog prisustva malih količina ozona u atmosferi), oksidacije vlažnog fosfora, djelovanja radijacionih zraka, ultraljubičastih ili katodnih zraka na atmosferski kisik, raspadanja hidrogen peroksida, elektrolize sumporne kiseline (itd.) ...
kiseline koje sadrže kisik), djelovanje fluora na vodu itd. Sadržaj u zemljinoj atmosferi je zanemariv; zračni slojevi u blizini zemljine površine sadrže manje ozona nego gornji slojevi atmosfere; na visini od 1.050 m(na području Mont Blanca) Levy je našao 0-3.7 mg,na visini od 3.000 m—9,4 mg. ozon na 100 m kocka zrak. Aparati - ozonizatori se koriste u tehnologiji i laboratorijama za proizvodnju ozona. Za ozonizaciju, kisik ili zrak se prenose između dvije elektrode spojene na izvor visokog napona.
Čisti ozon se oslobađa iz mješavine ozona i kisika kada se hladi tečnim zrakom. Ozon se razgrađuje lako, a razlaganje čistog ozona se ubrzava u prisustvu manganovog dioksida, olova, azot-oksida. U prisustvu vode usporava razgradnja ozona, suhi ozon na 0 ° razgrađuje se 30 puta brže od vlažnog ozona na 20,4 °. Ozon ima izuzetno snažno oksidacijsko djelovanje. On odvaja jod od kalijum jodida, oksidira živu, pretvara sumporne metale u sulfatne soli, obojava organske boje itd. Ozon uništava gumene cijevi. Eter, alkohol, lagani plin, pamučna vuna, u kontaktu sa visoko ozoniziranim kisikom, zapaliti. Pod djelovanjem ozona na nezasićene organske spojeve nastaju produkti dodavanja ozonida. Ozon se koristi za sterilizaciju vode, za dezodorizaciju - uklanjanje loših mirisa, u pripremnoj organskoj praksi.
Fizička svojstva
Hemijska svojstva i metode pripreme
Popis rabljene literature
- Volkov, A.I., Zharskiy, I.M. Velika hemijska referentna knjiga / A.I. Volkov, I.M. Zharsky. - Minsk: Moderna škola, 2005. - 608 s ISBN 985-6751-04-7.
Ozon je gas. Za razliku od mnogih drugih, nije proziran, ali ima karakterističnu boju i ujednačen miris. Prisutna je u našoj atmosferi i jedna je od njenih najvažnijih sastavnica. Kolika je gustoća ozona, njegova masa i druga svojstva? Kakva je njegova uloga u životu planete?
Plavi plin
U hemiji, ozon nema odvojeno mjesto u periodičnoj tabeli. To je zato što nije element. Ozon je alotropna modifikacija ili varijacija kiseonika. Kao i u O2, njegova molekula se sastoji samo od atoma kiseonika, ali nema ih dva, već tri. Stoga njegova hemijska formula izgleda poput O3.
Ozon je plavi gas. Ima izražen oštar miris, koji podseća na hlor, ako je koncentracija previsoka. Sjećate li se mirisa svježine kad pada kiša? Ovo je ozon. Zahvaljujući ovom svojstvu, dobio je ime, jer od starogrčkog jezika "ozon" je "miris".
Molekula plina je polarna, atomi u njoj povezuju se pod kutom od 116,78 °. Ozon nastaje kada je slobodan atom kisika vezan na molekulu O2. To se događa tijekom različitih reakcija, na primjer, oksidacije fosfora, električnog pražnjenja ili razgradnje peroksida, tijekom kojih se oslobađaju atomi kisika.
Ozonska svojstva
U normalnim uvjetima, ozon postoji s molekularnom težinom od gotovo 48 g / mol. To je dijamagnetično, odnosno nije u stanju da ga privuče magnet, baš kao što je srebro, zlato ili azot. Gustina ozona je 2,1445 g / dm³.
U čvrstom stanju, ozon dobija plavkasto-crnu boju, u tečnom stanju postaje indigo, blizak ljubičastom. Tačka ključanja je 111,8 stepeni Celzijusa. Na nula stupnjeva, rastvara se u vodi (samo u čistoj vodi) deset puta bolje od kisika. Dobro se miješa sa dušikom, fluorom, argonom, a pod određenim uvjetima i s kisikom.

Pod djelovanjem niza katalizatora, lako se oksidira, oslobađajući slobodne atome kisika. Spajajući se s njom, odmah se zapali. Tvar je sposobna oksidirati gotovo sve metale. Samo platina i zlato nisu podložni njegovom djelovanju. Razgrađuje razna organska i aromatična jedinjenja. U kontaktu s amonijakom formira amonijum nitrit, uništava dvostruke veze ugljika.
Ozon, prisutan u velikoj koncentraciji u atmosferi, razlaže se spontano. U tom se slučaju oslobađa toplina i stvara se molekula O2. Što je veća njegova koncentracija, jača je reakcija oslobađanja topline. Kada je sadržaj ozona veći od 10%, to prati eksplozija. S porastom temperature i padom tlaka ili pri kontaktu s organskim tvarima, razgradnja O3 događa se brže.
Istorija otkrića
U hemiji je ozon bio poznat tek u 18. vijeku. Otkriven je 1785. godine zahvaljujući mirisu koji je fizičar Van Marum čuo pored radne elektrostatičke mašine. 50 godina kasnije, on se nije uključio u naučne eksperimente i istraživanja.
Naučnik Christian Schönbein proučavao je oksidaciju bijelog fosfora 1840. godine. Tokom eksperimenata uspio je da izoluje nepoznatu tvar, koju je nazvao "ozonom". Hemičar se suočio sa proučavanjem njegovih svojstava i opisao metode dobijanja novootkrivenog gasa.
Ubrzo su se drugim znanstvenicima pridružili istraživanju tvari. Slavni fizičar Nikola Tesla čak je izgradio prvu u historiji.Industrijska upotreba O3 započela je krajem 19. stoljeća pojavom prvih postrojenja za opskrbu pitkom vodom kućama. Supstanca je korištena za dezinfekciju.

Ozon u atmosferi
Naša je Zemlja okružena nevidljivom ljuskom zraka - atmosferom. Bez njega život na planeti bio bi nemoguć. Sastavnice atmosferskog zraka: kisik, ozon, azot, vodonik, metan i drugi plinovi.
Sam ozon ne postoji i javlja se samo kao rezultat hemijskih reakcija. Blizu Zemljine površine, nastaje električnim izbacivanjem munje za vrijeme grmljavinske oluje. Na neprirodan način, čini se zbog emisije izduvnih gasova iz automobila, tvornica, benzinskih isparenja, djelovanja termoelektrana.

Ozon u donjoj atmosferi naziva se površinski ili troposferski ozon. Postoji i stratosferska. Nastaje pod utjecajem ultraljubičastoga zračenja koje dolazi od sunca. Nastaje na udaljenosti od 19-20 kilometara iznad površine planete i proteže se do visine od 25-30 kilometara.
Stratosferska O3 tvori ozonski omotač planete, koji je štiti od moćnog sunčevog zračenja. Apsorbira oko 98% UV zračenja dovoljno talasnom dužinom da izazove rak i opekotine.
Primjena tvari
Ozon je odličan oksidant i uništavač. Ovo svojstvo se dugo koristi za pročišćavanje vode za piće. Supstanca štetno utječe na bakterije i viruse opasne po ljude, a sama se, oksidirajući, pretvara u bezopasni kisik.
Sposobna je ubiti čak i organizme otporne na hlor. Osim toga, koristi se za pročišćavanje otpadnih voda od naftnih derivata, sulfida, fenola, koji su štetni za okoliš itd. Takve prakse su uobičajene uglavnom u Sjedinjenim Državama i nekim evropskim zemljama.
Ozon se koristi u medicini za dezinfekciju instrumenata, u industriji se koristi za izbjeljivanje papira, rafiniranje ulja i dobivanje različitih tvari. Upotreba O3 za pročišćavanje zraka, vode i prostorija naziva se ozoniranjem.

Ozon i čovjek
Uprkos svim svojim korisnim svojstvima, ozon može biti opasan za ljude. Ako u zraku ima više plina nego što čovjek može tolerirati, trovanje se ne može izbjeći. U Rusiji je njegova dozvoljena količina 0,1 μg / l.
Kada se ova norma premaši, pojavljuju se tipični znakovi hemijskog trovanja poput glavobolje, iritacije sluznice i vrtoglavice. Ozon smanjuje otpornost organizma na infekcije respiratornog trakta i takođe snižava krvni pritisak. Pri koncentraciji plina iznad 8-9 µg / l mogući su plućni edem, pa čak i smrt.
U isto vrijeme, lako je prepoznati ozon u zraku. Miris "svježine", hlora ili "rakova" (kako je tvrdio Mendeleev) jasno se čuje čak i sa beznačajnim sadržajem tvari.
1. Šta znamo o OZONE-u?
Ozon (od grčkog ozon - miriše) je plavi gas sa oštrim mirisom, jakim oksidansom. Ozon je alotrop kiseonika. Molekularna formula O3. Teži su od kisika 2,5 puta. Koristi se za dezinfekciju vode, hrane i zraka.
Tehnologija
Na osnovu tehnologije cozone ozona razvijen je multifunkcijski anionski ozonizator Green World koji koristi ozon za dezinfekciju i sterilizaciju.
Karakteristike hemijskog elementa ozona
Ozon, čije je naučno ime O3, nastaje kombiniranjem tri atoma kisika i ima visoke oksidacijske funkcije koje su efikasne u dezinfekciji i stearilizaciji. U stanju je uništiti većinu bakterija u vodi i zraku. Smatra se efikasnim dezinficijensom i antiseptikom. Ozon je bitna komponenta atmosfere. Naša atmosfera sadrži 0,01 ppm-0,04ppm ozon, koji uravnotežuje nivo bakterija u prirodi. Ozon se također proizvodi prirodnim udarom munje tokom oluje sa grmljavinom. Tokom električnog pražnjenja munje stvara se ugodan slatkast miris, koji nazivamo svježim zrakom.
Molekuli ozona su nestabilni i vrlo se brzo razgrađuju u molekule kiseonika. Ovakav kvalitet čini ozon vrijednim pročišćivačem plina i vode. Molekuli ozona kombiniraju se s molekulama drugih tvari i razgrađuju se, što rezultira oksidacijom organskih spojeva pretvarajući ih u bezopasni ugljični dioksid i vodu. Zbog činjenice da se ozon lako razgrađuje u molekulama kisika, mnogo je manje toksičan od ostalih dezinfekcijskih sredstava poput hlora. To se još naziva i "najčišćim oksidatorom i dezinficijensom".
Ozonska svojstva - ubija mikroorganizme
1. ubija bakterije
a) ubija većinu bakterija coli i stafilokoka u zraku
b) ubija 99,7% coli bakterija i 99,9% stafilokoka na površini objekata
c) ubija 100% bakterija coli, stafilokoka i mikroba iz grupe Salmonella u fosfatnim spojevima
d) ubija 100% bakterija coli u vodi
2.Ubija spore bakterija
a) uništava brevibacteiumspores
b) sposobnost uništavanja bakterija u zraku
c) u vodi 99,999% brevibacteiumspore
3.destruira viruse
a) uništava 99,99% HBsAg i 100% HAAg
b) uništava virus gripa u zraku
c) uništava virus PVI i hepatitis A u vodi u roku od nekoliko minuta ili minuta
d) uništava virus SA-11 u vodi
e) kada koncentracija ozona u serumu u krvi dosegne 4mg / l, može uništiti HIV pri 106cd50 / ml
a) ubija 100% aspergillusversicolor i penicillium
b) ubija 100% aspergillusniger-a, fusariumoxysporumf.sp.melonogea i fusariumoxysporumf.sp. lycopersici
c) ubija bakterije aspergillus niger i candida
2. Kako se u prirodi formira ozon?
Nastaje iz molekularnog kisika (O2) električnim pražnjenjem ili ultraljubičastim zračenjem. To je posebno vidljivo na mjestima bogatim kisikom: u šumi, u morskom području ili u blizini vodopada. Kada je izložen sunčevoj svjetlosti, kisik se u kapljici vode pretvara u ozon. Takođe možete osjetiti miris ozona nakon grmljavinske oluje, kada se on stvara električnim pražnjenjem.
3. Zašto se zrak čini čišćim nakon grmljavinske oluje?
Ozon oksidira nečistoće organske materije i dezinficira zrak, pružajući mu ugodnu svježinu (smrad groma). Karakterističan miris ozona pojavljuje se u koncentracijama od 10-7%.
4. Šta je ozonosfera? Kakav je njen uticaj na život na planeti?
Najveći dio ozona u atmosferi nalazi se na nadmorskoj visini od 10 do 50 km s maksimalnom koncentracijom na nadmorskoj visini od 20-25 km, formirajući sloj koji se naziva ozonosfera.
Ozonosfera odražava teško ultraljubičasto zračenje, štiti žive organizme od štetnog djelovanja zračenja. Naime, zahvaljujući stvaranju "ozona iz kisika u zraku, život na kopnu postao je moguć".
5. Kada je otkriven ozon i koja je historija njegove upotrebe?
Ozon je prvi put opisan 1785. godine. Holandski fizičar Mac Van Marum.
1832. godine. prof. Schonbein univerzitet u Bazelu objavio je knjigu "Proizvodnja hemijskog ozona". Dao mu je i ime "ozon" od grčkog "miriše".
1857. god. Werner von Siemens dizajnirao je prvo tehničko postrojenje za pročišćavanje pitke vode. Od tada, ozoniranje proizvodi higijenski čistu vodu.
Do 1977. više od 1000 instalacija za ozonizaciju vode za piće djeluje širom svijeta. Trenutno je 95% vode za piće u Evropi tretirano ozonom. Ozoniranje se široko koristi u Kanadi i SAD-u. U Rusiji postoji nekoliko velikih stanica koje se koriste za pročišćavanje vode za piće, pripremu vode u bazenima i za dubinsko pročišćavanje otpadnih voda u cirkulacijskoj vodoopskrbi autopraonica.
Ozon se prvi put koristio kao antiseptik tokom Prvog svjetskog rata.
Od 1935. godine. počela koristiti rektalnu primjenu smjese ozona i kisika za liječenje različitih crijevnih bolesti (proktitis, hemoroidi, ulcerozni kolitis, fistule, suzbijanje patogenih mikroorganizama, obnavljanje crijevne flore).
Proučavanje učinka ozona omogućilo je njegovu upotrebu u hirurškoj praksi za zarazne lezije, liječenje tuberkuloze, upale pluća, hepatitisa, herpes infekcije, anemije itd.
U Moskvi 1992. pod vođstvom počasnog naučnika Ruske Federacije, doktora medicinskih nauka Zmyzgovoy A.V. osnovan je naučno-praktični centar za ozonsku terapiju, gde se ozon koristi za lečenje širokog spektra bolesti. Nastavlja se razvoj djelotvornih neškodljivih metoda izlaganja primjenom ozona. Danas se ozon smatra popularnim i efikasnim sredstvom za dezinfekciju vode, vazduha i pročišćavanje hrane. Mešavine kiseonika i ozona takođe se koriste u lečenju različitih bolesti, kozmetologije i mnogih područja poslovanja.
6. Možete li udahnuti ozon? Da li je ozon štetan gas?
Zapravo, disanje u visokim koncentracijama ozona je opasno, ono može spaliti sluznicu disajnih organa.
Ozon je snažno oksidacijsko sredstvo. Tu se nalaze njegova pozitivna i štetna svojstva. Sve zavisi od koncentracije, tj. na procenat ozona u zraku. Njegovo djelovanje je poput vatre ... U malim količinama podržava i liječi, u velikim količinama može uništiti.
7. Kada se koriste niske i visoke koncentracije ozona?
Za dezinfekciju koriste se relativno visoke koncentracije, dok niže koncentracije ozona ne oštećuju strukture proteina i potiču ozdravljenje.
8. Kakav je uticaj ozona na viruse?
Ozon suzbija (inaktivira) virus i van i unutar ćelije i delimično uništava njegovu ovojnicu. Proces njegove reprodukcije se zaustavlja i narušava se sposobnost virusa da se povezuju sa ćelijama tijela.
9. Kako se manifestuje baktericidno svojstvo ozona kada je izloženo mikroorganizmima?
Kada su izloženi ozonskim mikroorganizmima, uključujući kvas, njihova ćelijska membrana je lokalno oštećena, što dovodi do njihove smrti ili nemogućnosti da se razmnožavaju. Zabilježeno je povećanje osjetljivosti mikroorganizama na antibiotike.
Eksperimenti su pokazali da plinoviti ozon ubija gotovo sve vrste bakterija, virusa, plijesni i gljivica i protozoa. Ozon u koncentracijama od 1 do 5 mg / l dovodi do smrti 99,9% Escherichia coli, streptokoka, mukobakterija, filokoka, E. coli i Pseudomonas aeruginosa, Proteus, Klebsiella, itd. U roku od 4-20 minuta.
10. Kako ozon djeluje u neživoj prirodi?
Ozon reagira s većinom organskih i neorganskih tvari. U procesu reakcija nastaju kisik, voda, ugljični oksidi i viši oksidi drugih elemenata. Svi ovi proizvodi ne zagađuju okoliš i ne dovode do stvaranja tvari koje stvaraju koncentraciju, za razliku od smjesa klora i fluora.
11. Mogu li se stvoriti opasni spojevi u stambenim prostorijama za vrijeme ozoniranja zraka?
Koncentracije ozona koje generira ozonizator u domaćinstvu dovode do stvaranja bezopasnih spojeva u stambenim prostorijama. Kao rezultat ozoniranja prostorije, povećava se sadržaj kiseonika u zraku i čišćenje virusa i bakterija.
12. Koji se spojevi formiraju kao rezultat ozoniranja zraka u zatvorenim prostorijama?
Većina sastojaka spojeva koji nas okružuju reagira s ozonom, što dovodi do stvaranja bezopasnih spojeva.
Većina se razgrađuje na ugljični dioksid, vodu i slobodni kisik. U nekim slučajevima nastaju neaktivni (bezopasni) spojevi (oksidi). Postoje i takozvane nereagenske supstance - oksidi titanijuma, silicijuma, kalcijuma itd. Ne reagiraju s ozonom.
13. Je li potrebno klimatizirati zrak u klimatiziranim sobama?
Nakon što zrak prođe kroz klima uređaje i uređaje za grijanje, sadržaj kisika u zraku opada, a razina toksičnih komponenti zraka se ne smanjuje. Osim toga, stari klima uređaji sami su izvor zagađenja i zagađenja. "Zatvoreni sindrom" - glavobolja, umor, česte respiratorne bolesti. Ozoniranje takvih prostorija jednostavno je potrebno.
14. Može li se klima uređaj dezinficirati?
Da, možeš.
15. Je li upotreba zraka za ozračivanje efikasna za uklanjanje mirisa dimnih prostorija i prostorija nakon popravka (mirisi boje, laka)?
Da, efikasno. Obradu treba obaviti nekoliko puta, u kombinaciji s mokrim čišćenjem.
16. Koje su koncentracije ozona štetne za bakterije, gljivice u zatvorenom prostoru?
Koncentracija 50 ozonskih čestica na 1.000.000.000 čestica zraka značajno smanjuje zagađenje zraka. Posebno snažno djeluje na Escherichia coli, Salmonella, Staphylococcus aureus, Candida, Aspergillius.
17. Jesu li sprovedena istraživanja o učincima ozoniziranog zraka na ljude?
Konkretno je opisan eksperiment, koji je sproveden pet meseci s dve grupe ljudi - kontrolom i testom.
Zrak u ispitnoj grupi bio je ispunjen ozonom u koncentraciji od 15 ozonskih čestica na 1.000.000.000 čestica vazduha. Svi ispitanici primijetili su dobro zdravstveno stanje, nestanak razdražljivosti. Liječnici su primijetili porast sadržaja kisika u krvi, jačanje imunološkog sustava, normalizaciju krvnog tlaka i nestanak mnogih simptoma stresa.
18. Je li ozon štetan za ćelije u tijelu?
Koncentracije ozona koje stvaraju ozonizatori u domaćinstvu suzbijaju viruse i mikroorganizme, ali ne oštećuju ćelije tela, jer ozon ne oštećuje kožu. Zdrave ćelije ljudskog tijela imaju prirodnu odbranu od štetnih učinaka oksidacije (antioksidans). Drugim riječima, učinak ozona je selektivan u odnosu na žive organizme.
To ne isključuje upotrebu mjera opreza. Tokom procesa ozoniranja, boravak u sobi je nepoželjan, a nakon postupka ozoniranja, sobu treba provjetravati. Ozonizator treba staviti izvan dohvata djece ili ga treba biti nemoguće uključiti.
19. Kakve su performanse ozonizatora?
U normalnim uslovima - 200 mg / sat, uz poboljšani režim - 400 mg / sat. Kolika je koncentracija ozona u sobi kao rezultat rada ozonizatora? Koncentracija ovisi o volumenu prostorije, lokaciji ozonizatora, vlažnosti zraka i temperaturi. Ozon nije uporan plin i brzo se raspada, pa koncentracija ozona jako ovisi o vremenu. Približni podaci 0,01 - 0,04 PPm.
20. Koje koncentracije ozona u zraku smatraju najvećim?
Koncentracije ozona u opsegu od 0,5 do 2,5 PPm (0,0001 mg / l) smatraju se sigurnim.
21. Za što se koristi ozoniranje vode?
Ozon se koristi za dezinfekciju, uklanjanje nečistoća, mirisa i boje vode.
1. Za razliku od kloriranja i fluoriranja vode, ozoniranje ne unosi ništa strano u vodu (ozon se brzo razgrađuje). U tom slučaju mineralni sastav i pH ostaju nepromijenjeni.
2. Ozon ima najveća dezinfekcijska svojstva protiv patogena.
3. Organske tvari u vodi se uništavaju i na taj način sprečavaju se daljnji razvoj mikroorganizama.
4. Bez stvaranja štetnih spojeva, većina kemikalija se uništava. Tu se ubrajaju pesticidi, herbicidi, naftni proizvodi, deterdženti, sumporni i hlorni spojevi koji djeluju kohegeno.
5. Metali se oksidiraju do neaktivnih spojeva, uključujući željezo, mangan, aluminijum itd. Oksidira talog i lako se filtrira.
6. Ozon koji se brzo razgrađuje pretvara se u kiseonik, poboljšavajući ukus i ljekovita svojstva vode.
23. Koji je indeks kiselosti vode nakon ozoniranja?
Voda ima blago alkalnu reakciju, pH \u003d 7,5 - 9,0. Ova voda se preporučuje za piće.
24. Koliki se udio kisika u vodi povećava nakon ozoniranja?
Sadržaj kisika u vodi povećava se 12 puta.
25. Koliko brzo se ozon razgrađuje u vazduhu, vodi?
U vazduhu nakon 10 minuta. koncentracija ozona smanjuje se za polovinu, formirajući kisik i vodu.
U vodi nakon 20-30 minuta. ozon se razgrađuje na pola, formirajući hidroksilnu grupu i vodu.
26. Kako zagrevanje vode utiče na sadržaj kiseonika u njoj?
Sadržaj kisika u vodi smanjuje se nakon zagrijavanja.
27. Šta određuje koncentraciju ozona u vodi?
Koncentracija ozona zavisi od nečistoće, temperature, kiselosti vode, materijala i geometrije rezervoara.
28. Zašto se koristi O3 molekula, a ne O 2 ?
Ozon je oko 10 puta topljiviji u vodi nego kisik i zadržava dobro. Što je niža temperatura vode, duže je vrijeme skladištenja.
29. Zašto je dobro piti kiseoničenu vodu?
Upotreba ozona povećava potrošnju glukoze u tkivima i organima, povećava zasićenost krvnom plazmom kisikom, smanjuje stupanj gladovanja kisikom i poboljšava mikrocirkulaciju.
Ozon ima pozitivan učinak na metabolizam jetre i bubrega. Podržava rad srčanog mišića. Smanjuje brzinu disanja i povećava volumen plime.
30. Čemu služi kućni ozonizator?
Ozonizator za domaćinstvo može se koristiti za:
dezinfekcija i dezodorizacija zraka u dnevnim boravcima, kupaonicama i wc-u, svlačionicama, ormarićima, hladnjakom itd .;
prerada hrane (meso, riba, jaja, povrće i voće);
poboljšanje kvaliteta vode (dezinfekcija, obogaćivanje kiseonikom, uklanjanje hlora i drugih štetnih nečistoća);
kućna kozmetologija (uklanjanje peruti, akni, ispiranje grla, četkanje zuba, uklanjanje gljivičnih bolesti, priprema ozoniranog ulja);
briga o kućnim ljubimcima i ribama;
zalijevanje sobnih biljaka i tretiranje sjemena;
izbjeljivanje i bojenje posteljine;
obrada cipela.
31. Kakav je efekat upotrebe ozona u medicinskoj praksi?
Ozon ima antibakterijsko, antivirusno dejstvo (inaktivacija virusa i uništavanje spora).
Ozon aktivira i normalizuje brojne biohemijske procese.
Učinak dobiven ozonskom terapijom karakteriše:
aktiviranje procesa detoksikacije, dolazi do supresije
aktivnost vanjskih i unutarnjih toksina;
aktiviranje metaboličkih procesa (metabolički procesi);
povećana mikrocirkulacija (opskrba krvlju)
poboljšanje reoloških svojstava krvi (krv postaje pokretna);
ima izražen analgetski efekat.
32. Kako ozon utiče na imunitet čovjeka?
Povećava se ćelijski i humoralni imunitet. Fagocitoza se aktivira, pojačava se sinteza interferona i drugih nespecifičnih tjelesnih sistema.
33. Kako ozoniranje utječe na metaboličke procese?
Upotreba ozona povećava potrošnju glukoze u tkivima i organima, povećava zasićenost krvnom plazmom kisikom, smanjuje stupanj gladovanja kisikom i poboljšava mikrocirkulaciju. Ozon ima pozitivan učinak na metabolizam jetre i bubrega. Podržava rad srčanog mišića. Smanjuje brzinu disanja i povećava volumen plime.
34. Ozon nastaje za vrijeme zavarivanja i za vrijeme rada fotokopir aparata. Je li ovaj ozon štetan?
Da, štetno je, jer stvara opasne nečistoće. Ozon koji proizvodi ozonizator čist je i samim tim neškodljiv.
35. Postoji li razlika između industrijskih, medicinskih i kućnih ozonizatora?
Industrijski ozonizatori proizvode visoke koncentracije ozona opasne za kućnu upotrebu.
Medicinski i kućanski generatori ozona slični su u pogledu performansi, ali medicinski su dizajnirani za duži kontinuirani rad.
36. Koje su komparativne karakteristike dezinfekcije prilikom upotrebe ultraljubičastih uređaja i ozonizatora?
Ozon u svojstvima ubijanja bakterija i virusa je 2,5 - 6 puta efikasniji od ultraljubičastih zraka i 300 - 600 puta efikasniji od hlora. Istovremeno, za razliku od hlora, ozon uništava čak i ciste glista i virusa herpesa i tuberkuloze.
Ozon uklanja organske i hemijske tvari iz vode, razlažući ih u vodu, ugljični dioksid, stvarajući talog neaktivnih elemenata.
Ozon lako oksidira željezove i manganove soli, tvoreći nerastvorive tvari, koje se uklanjaju taloženjem ili filtracijom. Kao rezultat, ozonirana voda je sigurna, bistra i ugodnog okusa.
37. Može li se posuđe dezinficirati ozonom?
Da! Dobro je dezinficirati dječja posuđa, posuđe za konzerviranje itd. Da biste to učinili, posuđe stavite u posudu s vodom, spustite zračni kanal razdjelnikom. Postupak 10-15 minuta.
38. Od kojih materijala treba napraviti pribor za ozonizaciju?
Staklo, keramika, drvo, plastika, emajl (baze čipsa i pukotina). Ne koristite metalne posude, uključujući aluminijske i bakrene posude. Guma ne podnosi kontakt s ozonom.
Anionski ozonizator iz američke korporacije Green World pomoći će vam ne samo da održavate, već i značajno poboljšavate svoje zdravlje. Imate priliku da u svom domu koristite nezamjenjivi uređaj - anionski ozonizator, koji objedinjuje sve kvalitete i funkcionalnosti i jonizatora zraka, i ozonizatora (višenamjenski ...
Ozonizator za automobil opremljen je osvjetljenjem i mirisom. Način ozoniranja i ionizacije može se istovremeno uključiti. Ovi se režimi mogu omogućiti pojedinačno. Ovaj je ozonizator neophodan za duga putovanja, kada se povećava umor vozača, pogoršanje vida i pamćenja. Ozonizator uklanja pospanost, daje energičnost zahvaljujući ...