Acidul oxalic
Agenția Federală pentru Educație
Instituție de învățământ de stat de învățământ profesional superior
UNIVERSITATEA TEHNICĂ DE STAT VOLGOGRAD
(VSTU)
Departamentul "Tehnologie cu greutate moleculară mare și materiale fibroase"
Lucrare semestrială
disciplină „Bazele proceselor chimice”
Tema: „Caracterizarea proceselor care apar în sinteza acidului oxalic. Calculul balanței de material și de căldură ".
Volgograd 2011
Proprietăți chimice.
Proprietăți fizice.
Metode de obținere.
cerere
Piața vânzărilor
GOST de vânzare
Echilibrul materialelor
Echilibrul de căldură
Proprietăți chimice:
Acidul oxalic (acid etanedioic) C2H2O4 este un acid carboxilic saturat dibasic. Aparține acizilor organici puternici. Are toate proprietățile chimice caracteristice acizilor carboxilici. Sărurile și esterii acidului oxalic se numesc oxalați. Se găsește în natură în sorel și în unele alte plante sub formă de potasiu și oxalați de calciu.
Acidul oxalic a fost sintetizat pentru prima dată în 1842 de un chimist german Friedrich Wöhler din Tizian. Acidul oxalic (sau ionul oxalat C 2 O 4 2-) este un agent reducător (decolorează soluția KMnO4).
Acidul oxalic este ușor solubil în apă și alcool. Acesta este un acid organic relativ puternic (clasa de pericol 3), NOOS-COOH, este un cristale igroscopice incolore, ușor solubil în apă, limitat în alcool etilic și dietil eter, insolubil în cloroform, eter de petrol și benzen. Formează un dihidrat de compoziție C 2 H 2 O 4 * 2H 2 O. Substanță combustibilă, în stare stabilită, pericol de incendiu. Are un puternic efect iritant asupra pielii, mucoaselor ochilor și ale tractului respirator superior.
Acidul oxalic are proprietățile chimice caracteristice acizilor carboxilici, formând două rânduri de derivați. Sărurile și esterii acidului oxalic se numesc oxalați. Acidul oxalic formează esteri acide și medii, amide, clorură acidă.
Acidul oxalic se găsește în sorel și rubarb sub formă de oxalat de potasiu.

Acest acid este foarte frecvent în lumea plantelor - sub formă de săruri se găsește în frunzele de sorel, acid, rubarb etc. Sărurile și esterii acestui acid au un nume banal - oxalați (din greacă. „Oxalis” - sorrel).
prezintă proprietățile generale ale acizilor deopotrivă. deoarece are o grupare funcțională carboxil. Reacția de formare a sării dovedește proprietățile acide ale acidului formic. În acest caz, se formează săruri - formate.
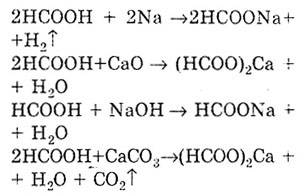
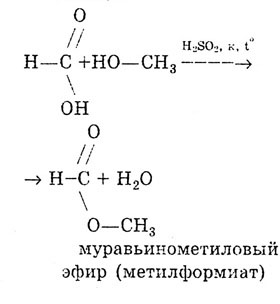
La fel ca toți acizii carboxilici, acidul formic formează esteri.
Reacția de esterificare:
Acidul formic diferă de alți acizi carboxilici prin faptul că gruparea carboxil din ea nu este legată de un radical hidrocarbonat, ci de un atom de hidrogen. Prin urmare, acidul formic poate fi considerat atât ca un acid cât și ca o aldehidă:

La fel ca aldehidele, acidul formic se poate oxida:
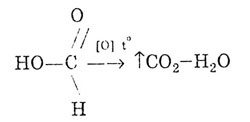
Acidul formic dă reacția „oglinzii de argint”:
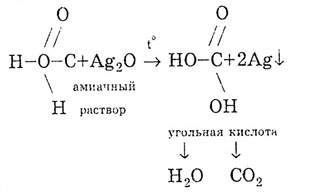
Acidul formic se descompune la încălzire:
![]()
acidul formic aparține seriei omoloage de acizi carboxilici monobasici
Proprietăți fizice:
Temperatura de sublimare: vezi notele ° C
Punctul de topire: 102 ° C
Densitatea relativă (apă \u003d 1): 1,7
Solubilitate în apă, g / 100 ml: 10
Presiunea de vapori, Pa la 30 ° C: vezi Note
Densitatea relativă a vaporilor (aer \u003d 1): 3.1
Acidul oxalic este unul dintre cei mai puternici acizi carboxilici, mult superior ca rezistență omologilor săi.
Acidul etanic prezintă proprietăți reducătoare: într-o soluție acidulată de permanganat de potasiu, este oxidat la monoxid de carbon (IV) și apă.
Când este încălzit în prezența acidului sulfuric, se produce decarboxilarea și se obține monoxid de carbon (IV) și acid formic.
Punctele de fierbere ale acizilor grași cu structură normală cresc în mod natural pe măsură ce numărul de atomi de carbon crește. S-a descoperit că moleculele de acid sunt asociate în același mod în care sunt asociate moleculele de apă sau alcool. Acizii inferiori sunt bine distilați cu vaporii de apă, motiv pentru care sunt de obicei numiți acizi grași volatili.
În general, crește punctele de topire ale acizilor monobasici cu o creștere a numărului de atomi de carbon din moleculele lor; dar, în același timp, se observă următoarea regularitate: acizii cu un lanț normal având un număr egal de atomi de carbon se topesc de obicei la o temperatură mai mare decât membrii precedenți și următorii din seria omologă având un număr impar de atomi de carbon.
PERICALE CHIMICE:
Substanța se descompune la încălzirea rapidă peste 150 ° C pentru a produce gaze toxice. O soluție apoasă este un acid de rezistență medie care reacționează violent cu baze puternice. Reacționează violent cu agenți de oxidare, ducând la pericol de incendiu și explozie. Reacționează cu argintul pentru a produce produse explozive.
De aplicare.
Acidul oxalic și sărurile sale sunt utilizate în industria textilă și a pielii ca mordant; ca o componentă a băilor cu anoduri pentru depunerea acoperirilor Al, Ti și Sn; ca reactiv în chimia analitică și organică; component al compozițiilor pentru curățarea metalelor de rugină și oxizi; pentru depunerea pământurilor rare. Oxamida este un stabilizator al nitraților de celuloză, cianul este un reactiv în sinteza organică, clorura de oxalil este un reactiv de clorură, clorocarbonilare și reticulare în sinteza organică. Ca solvenți de celuloză sunt folosiți oxalați de dialchil, în principal oxalat de dietil și oxalat de dibutil; unii esteri ai acidului oxalic și fenolilor substituiți - ca reactivi chemiluminiscenți.
Acidul oxalic este utilizat pentru lustruirea metalelor, în industria prelucrării lemnului, în purificarea uraniului
Câmpurile de aplicare a acidului oxalic și sărurile sale (oxalați):
în industria chimică (sinteză organică, în producerea de materiale plastice, cerneluri, în sinteza de coloranți, ca componentă a compozițiilor pirotehnice);
în metalurgia chimică (ca o componentă a compozițiilor pentru curățarea metalelor din rugină, cantar, oxizi);
în chimia analitică (ca precipitat al elementelor de pământuri rare);
în microscopie (ca înălbitor de secțiuni);
în industria textilă și a pielii (decaparea în imprimarea prin sită și vopsirea lânii și mătasii, la bronzarea pielii);
în producerea de detergenți sintetici (ca albire și dezinfectant, un mijloc de curățare și îndepărtare a pietrei urinare, sărurilor de duritate și ruginii);
în produse cosmetice (ca aditiv activ în creme de albire și creme din pistrui);
în sistemele de purificare a apei (metoda chimică de purificare și reducerea durității apei, purificarea lichidelor de răcire la centralele nucleare);
în medicamente și produse farmaceutice.
Metode de obținere:
1) Ca produs secundar în producerea acidului acetic prin oxidarea fazei lichide a butanului.
2) Oxidarea metanolului:
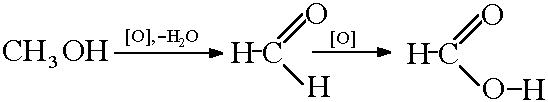
Reacția monoxidului de carbon cu hidroxidul de sodiu:
NaOH + CO → HCOONa → (+ H3SO4, −Na2SO4) HCOOH
Aceasta este principala metodă industrială, care se realizează în două etape: în prima etapă, monoxidul de carbon sub presiune de 0,6-0,8 MPa este trecut prin hidroxid de sodiu încălzit la 120-130 ° C; în a doua etapă, formatul de sodiu este tratat cu acid sulfuric, iar produsul este distilat în vid.
Descompunerea esterilor glicerolici ai acidului oxalic. Pentru a face acest lucru, glicerina anhidră cu acid oxalic este încălzită, în timp ce apa este distilată și se formează esteri oxalici. Odată cu încălzirea ulterioară, esterii se descompun, eliberând dioxid de carbon și se formează esteri formici, care după descompunerea cu apă dau acid formic și glicerină.
Acidul dibazic carboxilic limitant cu formula brută C2H2O4 este denumit, conform nomenclaturii sistematice, acid etanedioic. Această substanță este cunoscută și sub un alt nume, mai frecvent - acid oxalic. A fost obținut pentru prima dată de chimistul german F. Weller de la tizyan (acidul oxalic dinitril) în 1824. Cristalele de acid incolor se dizolvă în apă pentru a forma soluții incolore. Masa molară este 90,04 g / mol. În aparență, seamănă cu cristale monoclinice incolore. La o temperatură de 20 ° C, 8 g de acid oxalic se dizolvă în 100 g de apă. Este bine solubil în acetonă, alcool etilic și eter sulfuric. Densitate 1,36 g / cm³. Se topește la o temperatură de 189,5 ° C, se sublimează la 125 ° C, se descompune la 100-130 ° C.
Acidul oxalic are toate proprietățile chimice caracteristice acizilor carboxilici. Formula sa: NOOS - UNO. În ciuda faptului că aparține acizilor carboxilici, este considerat un acid organic puternic (3.000 de ori mai puternic decât acidul acetic): C2O4H2 → C2O4H- + H + (pK \u003d 1.27) și în continuare: C2O4H- → C2O42 - + H + (pK \u003d 4.27). Esterii și sărurile acestui acid se numesc oxalați. Ionul oxalat C2O42 - este un agent reducător. Când acidul oxalic reacționează cu (KMnO4), acesta din urmă este redus și soluția se decolorează. Se caracterizează printr-o reacție reversibilă și continuă lent de interacțiune cu alcoolii (esterificare), ca urmare a formării esterilor: HOOC - COOH + 2HOR ↔ 2H2O + ROOC - COOR.
În industrie, acidul oxalic este obținut prin oxidarea compușilor chimici. De exemplu, în prezența unui catalizator de vanadiu (V2O5), un amestec de acizi azotici (HNO3) și sulfuri (H2SO4) oxidează alcooli, carbohidrați și glicoli. De asemenea, se utilizează o metodă de oxidare a etilenei și acetilenei (HNO3) în prezența sărurilor de paladiu de Pd (NO3) 2 sau PdCl2. Acidul oxalic este obținut din propilenă, care este oxidată cu dioxid de azot lichid (NO2). Există o perspectivă bună pentru producerea unui acid prin reacția hidroxidului de sodiu (NaOH) cu monoxid de carbon (CO) printr-o etapă intermediară a formării NaOH + CO → HCOONa. Apoi se formează oxalat de sodiu și se eliberează hidrogen: HCOONa + NaOH → NaOOC - COONa + H2. Acidul oxalic este obținut din oxalatul de sodiu într-un mediu acid: NaOOC - COONa + 2H + → HOOC - COOH + 2Na +.
Acidul oxalic și oxalații sunt prezenți în multe plante, inclusiv ceaiul negru, găsit la animale. Principalul rău adus oamenilor este asociat cu insuficiența renală, care apare datorită interacțiunii acidului oxalic cu calciul, ceea ce duce la depunerea solidului (CaC2O4) - componenta principală a calculilor renali. Acidul provoacă dureri în articulații datorită depunerii de compuși similari în ele. Acidul oxalic se poate forma în organism ca urmare a metabolismului etilenglicolului din mediul înconjurător (de exemplu, un agent antigel pentru tratarea pistelor și aeronavelor din aeroporturi, precum și din alte surse create de om). Problemele potențiale cu oxalații din corpul uman pot fi împărțite în două. În primul rând, o macrocelelă importantă, calciul se leagă de acid oxalic și deficiența acestuia se formează în celulele țesuturilor și organelor. Al doilea este formarea de pietre la rinichi. Cele mai mari cantități de acid oxalic se găsesc în spanac, frunze și tulpini de rubarba, sorel, sfeclă, pătrunjel și ceapă verde.
- este un cristalin higroscopic monoclinic incolor, ușor solubil în apă, limitat la alcool etilic și dietil eter, insolubil în cloroform, eter de petrol și benzen.Acidul oxalic este un acid carboxilic limitant dibazic. Aparține acizilor organici puternici. Are toate proprietățile chimice caracteristice acizilor carboxilici. Sărurile și esterii acidului oxalic se numesc oxalați. Acidul oxalic formează esteri acide și medii, amide, clorură acidă.
În natură, se găsește în sorel, rubarb și în unele alte plante într-o formă liberă și sub formă de oxalați de potasiu și calciu.
Densitate 1,36 g / cm³. Punctul de topire - 189,5 ° C, temperatura de sublimare - 125 ° C, temperatura de descompunere - 100-130 ° C, temperatura de decarboxilare - 166-180 ° C.
Formula chimică: C2H2O4
 Utilizarea acidului oxalic.
Utilizarea acidului oxalic.
- în industria chimică (sinteza organică, la producerea de materiale plastice, cerneluri, în sinteza de coloranți, ca componentă a compozițiilor pirotehnice);
- în metalurgia chimică (ca o componentă a compozițiilor pentru curățarea metalelor din rugină, cantar, oxizi); - în chimia analitică (ca precipitat al elementelor de pământuri rare);
- în microscopie (ca înălbitor de secțiuni);
- în industria textilă și a pielii (decaparea în imprimarea prin sită și vopsirea lânii și mătasii, la bronzarea pielii);
- în producerea de detergenți sintetici (ca albire și dezinfectant, un mijloc de curățare și îndepărtare a pietrei urinare, a sărurilor de duritate și a ruginii);
- în produse cosmetice (ca aditiv activ în cremele de albire și creme din pistrui);
- în sistemele de purificare a apei (metoda chimică de purificare și reducerea durității apei, purificarea lichidelor de răcire la centralele nucleare);
- în medicamente și produse farmaceutice.
Cerințe de siguranță.
Acidul oxalic este o substanță combustibilă; în stare stabilizată, praful de acid oxalic este inflamabil;
Are un puternic efect iritant asupra pielii, mucoaselor ochilor și ale tractului respirator superior. Acidul oxalic și sărurile sale sunt toxice. Când lucrați cu acid oxalic, trebuie utilizat PPE.
Ambalare, transport și depozitare.
Acidul oxalic tehnic este ambalat în pungi de plastic sau în pungi din folie de plastic cu imprimare color. Poate fi, de asemenea, ambalat în tamburi de placaj cu un insert de pungă de film sau containere moi specializate pentru o singură utilizare.
Acidul oxalic este transportat prin toate modurile de transport. Depozitați ambalajele producătorului în depozite închise, ventilate, pe paleți.
Perioada de garanție a depozitării - 6 luni de la data fabricației.
(etavdioic) - acid carboxilic limitant dibasic, care este o substanță chimică sub formă de cristale incolore, solubil în apă, incomplet în dietil și alcool etilic, insolubil în benzen, cloroform, eter de petrol. Esterii și sărurile unui astfel de acid se numesc oxalați. Acest reactiv chimic este un acid organic puternic cu un punct de topire de -189,5 ° C. În natură, într-o formă liberă, acest compus chimic, precum și sub formă de oxalați (esteri și săruri ale acidului oxalic) de potasiu și calciu, se găsește în multe plante: rubarba, fasole, spanac, nuci, soia. Acest acid se formează în timpul fermentației oxalice. Pentru prima dată, acest tip de acid a fost obținut în timpul sintezei dizianului de către chimistul Friedrich Wöhler (Germania, 1824).
Utilizarea acidului oxalic
Ca orice acid, oxalicul, datorită proprietăților sale unice, este utilizat în următoarele industrii:
- chimice (la fabricarea materialelor plastice, coloranților, cernelurilor, pirotehnicii);
- metalurgic (pentru curățarea metalelor de coroziune, oxizi, scară, rugină);
- material textil și piele (ca mordant, la vopsirea mătase și lână);
- apicultura (pentru prelucrarea albinelor);
- substanțe chimice de uz casnic (incluse în mulți detergenți și pulberi ca albire și dezinfectant);
- chimie analitică (precipitat de pământuri rare);
- microscopie (secțiuni de înălbitor);
- cosmetologie (component de albire de la pistrui);
- medicamente și farmacologie;
- prelucrarea lemnului
Importanța acidului oxalic pentru organism
Acest compus chimic din corpul uman este un produs intermediar care este excretat în urină sub formă de săruri de calciu. În cazul încălcării metabolismului mineral, sărurile acestui acid participă la formarea de pietre în vezică și rinichi. Acest acid organic găsit în legumele crude este foarte benefic pentru organismul nostru. Se combină ușor cu calciul și contribuie la absorbția acestuia. Acidul oxalic din legumele fierte afectează negativ sănătatea, deoarece devine anorganic. Aceasta duce la legarea calciului și, ca urmare, la lipsa acestuia în țesutul osos, care este cauza deteriorarii acestuia. Excreția zilnică de acid oxalic cu urină la un adult este de 20 mg, la copii până la 1,29 mg / kg.
Măsuri de siguranță
 Acidul oxalic este un reactiv chimic combustibil, foarte toxic și toxic, prin urmare, numai personalul de laborator care a urmat o pregătire specială în privința măsurilor de siguranță este autorizat să lucreze cu acesta:
Acidul oxalic este un reactiv chimic combustibil, foarte toxic și toxic, prin urmare, numai personalul de laborator care a urmat o pregătire specială în privința măsurilor de siguranță este autorizat să lucreze cu acesta:
- desfășurați lucrări într-o sticlărie specială de laborator. Dacă sticla de laborator este dintr-un alt material, acidul poate reacționa cu acesta;
- pentru a evita ingestia acidului oxalic pe piele, tractul respirator, membranele mucoase, toate studiile trebuie efectuate: în produsele din cauciuc (cizme, șorțuri cauciucate, mănuși de examinare, mănuși din nitril), echipament de protecție (mască sau respirator, ochelari), îmbrăcăminte de protecție;
- în timpul utilizării acidului oxalic este interzis să mănânci, să bei, să fumezi;
- după finalizarea lucrărilor, este necesar să clătiți bine fața și mâinile cu apă caldă și săpun sau cu un agent de neutralizare (soluție de băut sodă);
- transportul și depozitarea acidului oxalic împreună cu alimentele sunt interzise;
- respectați măsurile de securitate la incendiu, dacă este nevoie de utilizarea dispozitivelor de încălzire.
Trebuie să știți că acidul oxalic este un acid organic puternic, utilizarea lui în cantități mari poate provoca iritarea membranei mucoase a esofagului, intestinelor, stomacului, pielii și tractului respirator. Dacă acest reactiv chimic intră în corp, poate apărea o senzație de arsură, vărsături sângeroase. Primul ajutor în astfel de situații este să clătiți bine cu apă pe zona afectată a pielii. Depozitați acidul într-o pungă de plastic închisă într-o zonă bine ventilată pe paleți.
Pentru a cumpăra acid oxalic
Pentru a cumpăra acid oxalic, a cumpăra acid boric, a cumpăra acid citric, a cumpăra acid lactic, precum și orice alt reactiv chimic, este posibil în magazinul de reactiv chimic din Moscova, cu amănuntul și cu ridicata „Prime Chemicals Group”. Site-ul nostru are tot ceea ce are nevoie de un laborator științific sau de producție modern. Când cumpărați orice produs din magazinul nostru online, achiziționați un produs cu un certificat de calitate care respectă toate standardele GOST la prețuri accesibile și exclude posibilitatea de a cumpăra un fals.
„Prime Chemicals Group” - o garanție a calității produselor oferite.
Puteți cumpăra acid oxalic cu livrare în oraș și regiune Favorabil!
Acidul oxalic (etanedioic) este un compus carboxilic dibazic aparținând clasei de acizi organici puternici.
 Substanța este distribuită pe scară largă în natură, întâlnită sub formă de săruri, esteri, amide, izomeri liberi. Principalele surse de acid oxalic sunt rubarba proaspătă, spanacul, sorelul și sfecla de frunze. Aceste produse „livrează” organismului și sunt necesare pentru hematopoieză, stimulând și intestinele.
Substanța este distribuită pe scară largă în natură, întâlnită sub formă de săruri, esteri, amide, izomeri liberi. Principalele surse de acid oxalic sunt rubarba proaspătă, spanacul, sorelul și sfecla de frunze. Aceste produse „livrează” organismului și sunt necesare pentru hematopoieză, stimulând și intestinele.
Pentru prima dată, acidul etanedioic a fost sintetizat din dician în 1824 de biochimistul german Friedrich Weller. La scară industrială, se obține prin oxidarea zahărului cu acid azotic în prezența unui catalizator pentru reacția pentoxidului de vanadiu. Sub formă de oxalat de calciu, compusul se găsește în toate plantele.
Efecte asupra corpului uman
Acidul oxalic este implicat în metabolismul esențial și are, de asemenea, un efect bactericid asupra tractului digestiv.
Necesarul zilnic de o substanță este de 20 până la 30 de miligrame. Nivelul superior admis de acid este de 50 miligrame, depășirea acestui prag duce la dezvoltarea simptomelor de supradozaj în organism.
![]() Compusul carbon este utilizat în următoarele patologii:
Compusul carbon este utilizat în următoarele patologii:
- infertilitate;
- dureri de cap (migrene);
- menopauză atipică;
- amenoree;
- infestări helmintice;
- sângerare;
- tuberculoza cronică;
- impotenta;
- sinuzită, sinuzită;
- intestine lente;
- dureri reumatice;
- perioade dureroase cu sângerare grea;
- trichomoniaza, clamidia;
- infecții intestinale (Staphylococcus aureus, Escherichia coli, holeră, febră tifoidă).
Nu uitați, consumul excesiv de alimente oxalice duce la întreruperea absorbției calciului. Ca urmare, pietrele oxalate se formează în organele genitourinare. În același timp, cristalele dăunătoare „merg” de-a lungul canalelor urinare, rănind mucoasa și colorarea cu un pigment negru de sânge. Drept urmare, o persoană are dureri acute în cavitatea abdominală, inghinal și în spate, urinarea este dificilă, culoarea urinei se schimbă.
Aportul de porțiuni mari de acid, pe lângă formarea pietrei, provoacă următoarele probleme:
- slăbiciune;
- greață;
- stomac deranjat;
- amețeli;
- arderea sinusurilor, gurii, gâtului;
- tăiat în stomac.
În cazuri severe, respirația este dificilă și durerea apare în stern.
În plus, retenția de acid etanedioic în organism se poate datora tulburărilor nervoase. Pentru a stabiliza echilibrul acid ̶ alcalin, pe lângă reducerea consumului de produse oxalice se iau complexe sedative. Dacă nu puteți opri simptomele excesului de unul singur, trebuie să consultați imediat un gastroenterolog.
cerere
 Datorită proprietăților bactericide și de albire, acidul oxalic este utilizat cu succes în următoarele industrii:
Datorită proprietăților bactericide și de albire, acidul oxalic este utilizat cu succes în următoarele industrii:
- metalurgic (pentru curățarea metalelor de la scară, coroziune, rugină, oxizi);
- chimice (la fabricarea de coloranți, materiale plastice, cerneluri, pirotehnice);
- textile (ca mordant pentru vopsirea lânii și mătasei);
- microscopie (pentru secțiuni de albire);
- agricultura (ca insecticid);
- farmacologie;
- pentru prelucrarea lemnului;
- cosmetologie (ca parte a cremelor de albire, măști și seruri);
- chimie analitică (pentru depunerea pământurilor rare);
- substanțe chimice casnice (ca o componentă de albire și dezinfectare a detergenților).
În plus, substanța este utilizată pentru a crea aditivi alimentari și complexe biologic active (ca conservant).
Măsuri de siguranță
Acidul oxalic, utilizat în industrie, este un reactiv extrem de toxic din a treia clasă de pericol. Prin urmare, atunci când lucrați cu acesta, este important să respectați măsurile de siguranță.
![]() Măsuri de precauție:
Măsuri de precauție:
- Efectuați orice cercetare în îmbrăcăminte tehnică din cauciuc (cizme, mănuși, șorț) și echipament de protecție (respirator sau mască de gaz, ochelari de protecție). Respectarea acestei cerințe va ajuta la evitarea obținerii de acid etanedioic pe piele, mucoase ale feței, în tractul respirator.
- Lucrări desfășurate într-un vas de sticlă. Dacă echipamentul de laborator este format dintr-un alt material, acidul poate reacționa cu acesta.
- În procesul de utilizare a substanței, este strict interzis să bea, să fumeze, să mănânce alimente.
- După terminarea lucrului cu compusul, spălați-vă bine fața și mâinile cu apă și săpun.
- Transportul comun de acid și alimente este strict interzis.
- Dacă este necesar, folosiți aparate de încălzire pentru a respecta normele de securitate la incendiu.
- Depozitați compusul într-un recipient de plastic închis pe paleți într-o zonă ventilată.
Dacă acidul tehnic ajunge pe piele, capacul afectat este clătit abundent cu apă și, dacă este necesar, solicitați ajutor medical.
Izvoarele naturale
Comorile de acid etanedic sunt produse de origine vegetală: concentrația substanței în frunzele plantelor este mult mai mare decât în \u200b\u200btulpinile și rădăcinile.
| Numele produsului | Conținutul de carbon de 100 de grame de alimente, miligrame |
|---|---|
| măcriș | 700 — 850 |
| rubarbă | 850 |
| spanac | 600 – 750 |
| Frunza de Buriak | 500 — 670 |
| sparanghel | 640 |
| Boabe de cacao | 550 — 600 |
| sfeclă | 500 |
| Boabe de grâu germinate | 270 |
| Alune prăjite | 180 |
| Ciocolata neagra | 110 |
| pătrunjel | 100 |
| Coaja de lamaie, tei | 90 |
| praz | 85 |
| struguri | 26 |
| țelină | 20 |
| Coacăz roșu | 19 |
| vânătă | 18 |
| căpșune | 16 |
| Mazăre verde (proaspătă) | 15 |
| zmeură | 14 |
| Semănat Parsnip | 11 |
| prune | 10 |
| prune uscate | 6 |
| Boabe de sparanghel | 5,5 |
| piersici | 5 |
| Coacăz negru | 4,5 |
| Paine alba | 4,5 |
| Ceai negru | 4,5 |
| portocale | 4 |
| morcovi | 4 |
| Mere, pere | 3 |
| roșii | 2 |
| cireș | 1,5 |
| castraveți | 1 |
Acidul oxalic în cantități mici (0,3 - 2 miligrame) este prezent în toate produsele lactate, din carne și pește.
Este interesant faptul că în procesul de tratare termică a produselor, substanța intră într-o formă anorganică, formând săruri (oxalați) puțin solubile cu calciu. Consumul regulat al unei astfel de alimente, pe lângă formarea de piatră, duce la o încălcare a absorbției calciului și, ca urmare, la distrugerea oaselor și a cartilajului.
Acidul etanodic este un mijloc eficient de combatere a distrugerilor provocate de albine (varroatoză, acarapidoză).
Elimina invazia prin pulverizare fină a insectelor cu soluție oxală. Pentru a face acest lucru, 20 de grame de acid tehnic se dizolvă într-un litru de apă caldă și nu tare (se obține un insecticid de apă la două procente). Compoziția este preparată imediat înainte de utilizare.
Pentru a sigila albinele, ele scoate din pergovie stup și faguri pline de miere. După aceea, scoate cadre cu insecte, pulverizându-le pe ambele părți. Prelucrarea unui design consumă 10 până la 12 mililitri de soluție.
În cazul utilizării de vapori de acid oxalic, camera superioară este închisă în stup, iar în partea inferioară sunt introduse 10-14 pufuri de fum. Apoi, se toarnă 2 grame de substanță în compartimentul de lucru (pentru fiecare 10 - 15 rame jignite), încălzindu-se conducta de ieșire cu un suflare (5 - 6 secunde). După aceea, încălzitorul este introdus în orificiul robinetului timp de 30 - 40 de secunde, în așteptarea apariției smogului din probele fumătorului. După gravare, aerul este pompat în cameră folosind o pompă auto (4 până la 7 timpi).
Prelucrarea cu compus oxalic se efectuează de 2-5 ori pe an. Este recomandabil să utilizați o soluție apoasă la o temperatură ambientală de cel puțin 16 grade, și vapori de acid de cel puțin 10 grade. Tratamentul primar al stupilor se realizează la începutul primăverii, după un zburator masiv de albine. Cu o invazie severă, procedura se repetă după 7 până la 12 zile. Procesarea secundară a albinelor se realizează vara, după pomparea mierii comercializate și înainte de alimentarea insectelor. În cazul în care este nevoie de pansament de toamnă, procedura se efectuează după eliberarea de „toalere” din puiet.
concluzie
Deci, acidul oxalic este un compus natural care face parte din produsele pe bază de plante. Substanța promovează o hematopoieză adecvată, accelerează metabolismul, „dezinfectarea” tractului digestiv. Principalele surse de acid etanedioic sunt sorelul, spanacul, rubarbul, pudra. Nivelul optim de consum al elementelor este de 20-30 de miligrame pe zi. Cu toate acestea, este important să luăm în considerare faptul că excesul de acid din organism este plin de formarea de pietre oxalate în organele urogenitale. Prin urmare, este recomandabil persoanelor cu boli de rinichi, artrită reumatoidă, diabet cu acid uric și gută să-și limiteze aportul de această substanță.