Щавелева кислота
Федеральне агентство з освіти
Державна освітня установа вищої професійної освіти
Волгоградського державного технічного університету
(ВолгГТУ)
Кафедра «Технологія високомолекулярних і волокнистих матеріалів»
семестрова робота
з дисципліни «Основи хімічний процесів»
Тема: «Характеристика процесів, що протікають при синтезі щавлевої кислоти. Розрахунок матеріального і теплового балансу ».
Волгоград 2011
Хімічні властивості.
Фізичні властивості.
Способи отримання.
застосування
Ринок збуту
ГОСТи для продажу
матеріальний баланс
тепловий баланс
Хімічні властивості:
Щавлева кислота (етандіовая кислота) З 2 H 2 O 4 - двухосновная гранична карбонова кислота. Належить до сильних органічних кислот. Володіє усіма хімічними властивостями, характерними для карбонових кислот. Солі та ефіри щавлевої кислоти називаються оксалатами. У природі міститься в щавлі і деяких інших рослинах у вигляді оксалатів калію і кальцію.
Вперше щавлева кислота синтезована в 1842 році німецьким хіміком Фрідріхом Велером з диціану. Щавлева кислота (або оксалат-іон C 2 O 4 2-) є відновником (знебарвлює розчин KMnO4).
Щавлева кислота легко розчинна у воді і спирті. Це відносно сильна органічна кислота (3 клас небезпеки), ноос-СООН, являє собою безбарвні гігроскопічні кристали, легко розчинна у воді, обмежено - в етиловому спирті і діетиловому ефірі, нерастворима в хлороформі, петролейном ефірі і бензолі. Утворює дигідрат складу З 2 H 2 O 4 * 2Н 2 О. Горюча речовина, в який осів стані пожежонебезпечна. Володіє сильним подразнюють шкіру, слизові оболонки очей і верхніх дихальних шляхів.
Щавлева кислота має хімічними властивостями, характерними для карбонових кислот, утворюючи два ряди похідних. Солі та ефіри щавлевої кислоти називаються оксалатами. Щавлева кислота утворює кислі і середні ефіри, аміди, хлорангидрид.
Щавлева кислота міститься в щавлі і ревені у вигляді оксалату калію.

Ця кислота дуже поширена в рослинному світі - у вигляді солей вона міститься в листі щавлю, кислиці, ревеню тощо Солі та ефіри це кислоти мають тривіальне назва - оксалати (від грец. «Oxalis» - щавель).
проявляє загальні властивості кислот, так. як має функціональну карбоксильну групу. Реакція солеутворення доводить кислотні властивості мурашиної кислоти. При цьому утворюються солі - Форміат.
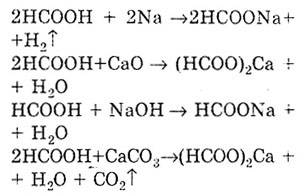
Як і всі карбонові кислоти, мурашина кислота утворює складні ефіри.
Реакція етерифікації:
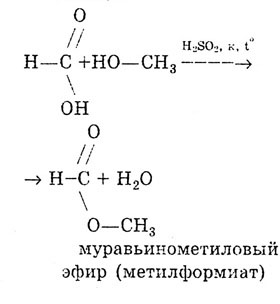
Від інших карбонових кислот мурашина кислота відрізняється тим, що карбоксильна група в ній пов'язана не з вуглеводневим радикалом, а з атомом водню. Тому мурашину кислоту можна розглядати і як кислоту, і як альдегід:

Подібно альдегідів, мурашина кислота може окислюватися:
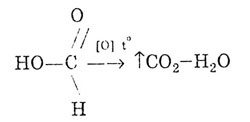
Мурашина кислота дає реакцію «срібного дзеркала»:
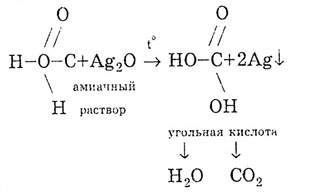
Мурашина кислота розкладається при нагріванні:
![]()
мурашина кислота відноситься до гомологічного ряду одноосновних карбонових кислот
Фізичні властивості:
Температура сублімації: см. Примітки ° C
Температура плавлення: 102 ° C
Відносна щільність (вода \u003d 1): 1.7
Розчинність в воді, г / 100 мл: 10
Тиск пару, Па при 30 ° C: см. Примітки
Відносна щільність пари (повітря \u003d 1): 3.1
Щавлева кислота - одна з найсильніших карбонових кислот, далеко перевершує за силою свої гомологи.
Етандіовая кислота проявляє відновні властивості: в подкисленном розчині перманганату калію вона окислюється до оксиду вуглецю (IV) і води.
При нагріванні в присутності сірчаної кислоти відбувається декарбоксилювання, і виходить оксид вуглецю (IV) і мурашина кислота.
Температури кипіння жирних кислот нормального будови закономірно зростають у міру збільшення числа вуглецевих атомів. Встановлено, що молекули кислот асоційовані подібно до того, як асоційовані молекули води або спиртів. Нижчі кислоти добре перегоняются з водяною парою, тому їх зазвичай називають летючими жирними кислотами.
Температури плавлення одноосновних кислот у міру збільшення в їх молекулах числа вуглецевих атомів в загальному також зростають; але при цьому спостерігається наступна закономірність: кислоти з нормальною ланцюгом, що мають парне число вуглецевих атомів, плавляться зазвичай при більш високій температурі, ніж попередній і наступний члени гомологічного ряду, що мають непарну кількість вуглецевих атомів.
ХІМІЧНА НЕБЕЗПЕКА:
Речовина розкладається при швидкому нагріванні вище приблизно 150 ° C з утворенням токсичного газу. Водний розчин є кислотою середньої сили яка бурхливо реагує з сильними основами. Реагує бурхливо з окислювачами приводячи до небезпеки виникнення пожежі та вибуху. Реагує з сріблом з утворенням вибухонебезпечних продуктів.
Застосування.
Щавлеву кислоту і її солі застосовують у текстильній та шкіряній промисловості в якості протрави; як компонент анодних ванн для осадження Al, Ti і Sn покриттів; як реагент в аналітичній і органічної хімії; компонент складів для очищення металів від іржі і оксидів; для осадження рідкісноземельних елементів. Оксамід - стабілізатор нітратів целюлози, ціан - реагент в органічному синтезі, оксалілхлорид - хлорує, хлоркарбонілірующій і зшиває реагент в органічному синтезі. Діалкілоксалати, головним чином діетілоксалат і дібутілоксалат, застосовують як розчинники целюлози; деякі ефіри щавлевої кислоти і заміщених фенолів - в якості хемілюмінесцентних реагентів.
Щавлева кислота використовується для полірування металів, у деревообробній промисловості, при очищенні урану
Області застосування щавлевої кислоти і її солей (оксалатів):
в хімічній промисловості (органічний синтез, при виробництві пластмас, чорнила, в синтезі барвників, як компонент піротехнічних складів);
в хімічній металургії (як компонент складів для очищення металів від іржі, накипу, оксидів);
в аналітичній хімії (як осадителя рідкоземельних елементів);
в мікроскопії (в якості відбілювача зрізів);
в текстильній і шкіряній промисловості (протрава в ситцедрукуванні і при фарбуванні вовни і шовку, для дублення шкіри);
при виробництві синтетичних миючих засобів (як відбілюючого і дезинфікуючий засіб, засоби для чищення та видалення сечового каменю, солей жорсткості та іржі);
в косметиці (як активна добавка в відбілюючих кремах і кремах від веснянок);
в системах очищення води (хімічний спосіб очищення і зниження жорсткості води, очищення теплоносіїв на АЕС);
в медицині і фармацевтиці.
Способи отримання:
1) Як побічний продукт у виробництві оцтової кислоти Рідкофазний окисленням бутану.
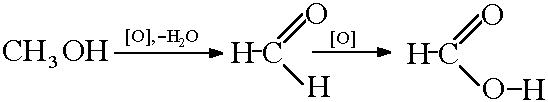
2) Окислення метанолу:
Реакцією монооксиду вуглецю з гідроксидом натрію:
NaOH + CO → HCOONa → (+ H3SO4, -Na2SO4) HCOOH
Це основний промисловий метод, який здійснюють у дві стадії: на першій стадії монооксид вуглецю під тиском 0,6-0,8 МПа пропускають через нагрітий до 120-130 ° C гідроскід натрію; на другій стадії проводять обробку форміату натрію сірчаною кислотою і вакуумну перегонку продукту.
Розкладанням гліцеринових ефірів щавлевої кислоти. Для цього нагрівають безводний гліцерин зі щавлевої кислотою, при цьому відганяється вода і утворюються щавлеві ефіри. При подальшому нагріванні ефіри розкладаються, виділяючи вуглекислий газ, причому утворюються мурашині ефіри, які після розкладання водою дають мурашину кислоту і гліцерин.
Гранична карбонова двухосновная кислота з брутто-формулою C2H2O4 називається, за систематичною номенклатурою, етандіовой кислотою. Ця речовина також відомо під іншим, більш поширеним назвою - щавлева кислота. Вперше вона була отримана німецьким хіміком Ф. Велером з диціану (динітрилу щавлевої кислоти) в 1824 році. Безбарвні кристали кислоти розчиняються у воді з утворенням безбарвних розчинів. Маса молярна становить 90,04 г / моль. За зовнішнім виглядом нагадує моноклінні безбарвні кристали. При температурі 20 ° С в 100 г води розчиняється 8 г щавлевої кислоти. Добре розчиняється в ацетоні, етиловому спирті і сірчаному ефірі. Щільність 1,36 г / см ³. Плавиться при температурі 189,5 ° С, переганяється при 125 ° С, розкладається при 100-130 ° С.
Всіма хімічними властивостями, характерними для карбонових кислот, володіє щавлева кислота. Формула її: ноос-СООН. Незважаючи на те, що відноситься до карбонових кислот, вважається сильною органічною кислотою (в 3000 разів сильніше, ніж оцтова кислота): C2O4H2 → C2O4H- + H + (рК \u003d 1,27) і далі: C2O4H- → C2O42 - + H + (рК \u003d 4,27). Ефіри й солі цієї кислоти називають оксалатами. Оксалат-іон C2O42- є відновником. При взаємодії щавлевої кислоти з (KMnO4) останній відновлюється і розчин знебарвлюється. Для неї характерна оборотна і повільно протікає реакція взаємодії зі спиртами (етерифікація), в результаті якої утворюються складні ефіри: HOOC-COOH + 2HOR ↔ 2H2O + ROOC-COOR.
У промисловості щавлева кислота виходить окисленням хімічних сполук. Наприклад, в присутності ванадієвого каталізатора (V2O5) сумішшю азотної (HNO3) і сірчаної (H2SO4) кислот окислюють спирти, вуглеводи і гліколі. Також застосовується спосіб окислення етилену і ацетилену (HNO3) в присутності паладієвих солей Pd (NO3) 2 або PdCl2. Щавлеву кислоту отримують з пропилену, який окислюють рідким діоксидом азоту (NO2). Має хорошу перспективу спосіб отримання кислоти взаємодією гідроксиду натрію (NaOH) з чадним газом (CO) через проміжну стадію утворення NaOH + CO → HCOONa. Потім утворюється оксалат натрію і виділяється водень: HCOONa + NaOH → NaOOC-COONa + H2. З оксалату натрію в кислому середовищі виходить кислота щавлева: NaOOC-COONa + 2H + → ноос-СООН + 2Na +.
Щавлева кислота і оксалати присутня в багатьох рослинах, в тому числі в чорному чаї, зустрічаються в організмі тварин. Основну шкоду для людини пов'язаний з нирковою недостатністю, яка виникає через взаємодію щавлевої кислоти з кальцієм, в результаті відбувається осадження твердого (СаС2O4) - основний компонент каменів в нирках. Кислота провокує болі в суглобах через осадження в них подібних з'єднань. Щавлева кислота може утворюватися в організмі в результаті метаболізму етиленгліколю, що надходить з навколишнього середовища (наприклад, антіобледенітельних засіб для обробки злітно-посадкових смуг і літаків в аеропортах, а також з інших антропогенних джерел). Потенційні проблеми з оксалатами в організмі людини можна розділити на дві. Перша - важливий макроелемент кальцій зв'язується щавлевої кислотою і утворюється його дефіцит в клітинах тканин і органів. Друга - утворення каменів в нирках. Найбільша кількість щавлевої кислоти міститься в шпинаті, листі і стеблах ревеню, щавлі, буряках, петрушці, зеленій цибулі.
- являє собою безбарвні моноклінні гігроскопічні кристали, легко розчинні у воді, обмежено - в етиловому спирті і діетиловому ефірі, нерозчинні в хлороформі, петролейном ефірі і бензолі.Щавлева кислота це двухосновная гранична карбонова кислота. Належить до сильних органічних кислот. Володіє усіма хімічними властивостями, характерними для карбонових кислот. Солі та ефіри щавлевої кислоти називаються оксалатами. Щавлева кислота утворює кислі і середні ефіри, аміди, хлорангидрид.
У природі міститься в щавлі, ревені і деяких інших рослинах у вільному вигляді і у вигляді оксалатів калію і кальцію.
Щільність 1,36 г / см ³. Температура плавлення - 189,5 ° C, температура сублімації - 125 ° C, температура розкладання - 100-130 ° C, температура декарбоксилирования - 166-180 ° C.
Хімічна формула: З 2 Н 2 O 4
 Застосування щавлевої кислоти.
Застосування щавлевої кислоти.
- у хімічній промисловості (органічний синтез, при виробництві пластмас, чорнила, в синтезі барвників, як компонент піротехнічних складів);
- у хімічній металургії (як компонент складів для очищення металів від іржі, накипу, оксидів); - в аналітичній хімії (як осадителя рідкоземельних елементів);
- в мікроскопії (в якості відбілювача зрізів);
- у текстильній та шкіряній промисловості (протрава в ситцедрукуванні і при фарбуванні вовни і шовку, для дублення шкіри);
- при виробництві синтетичних миючих засобів (як відбілюючого і дезинфікуючий засіб, засоби для чищення та видалення сечового каменю, солей жорсткості та іржі);
- в косметиці (як активна добавка в відбілюючих кремах і кремах від веснянок);
- в системах очищення води (хімічний спосіб очищення і зниження жорсткості води, очищення теплоносіїв на АЕС);
- в медицині і фармацевтиці.
Вимоги безпеки.
Щавлева кислота - горюча речовина, в який осів стані пил щавлевої кислоти пожежонебезпечна, за ступенем впливу на організм відноситься до речовин 2-го класу небезпеки.
Володіє сильним подразнюють шкіру, слизові оболонки очей і верхніх дихальних шляхів. Щавлева кислота і її солі токсичні. При роботі з щавлевої кислотою слід застосовувати ЗІЗ.
Упаковка, транспортування та зберігання.
Щавлева кислота технічна упаковується в мішки поліетиленові або в мішки, виготовлені з поліетиленової плівки з кольоровим друком. Так само може упаковуватися в фанерні барабани з плівковим мішком-вкладишем або м'які спеціалізовані контейнери разового використання.
Щавлеву кислоту транспортують усіма видами транспорту. Зберігають в упаковці виробника в закритих, вентильованих складських приміщеннях на піддонах.
Гарантійний термін зберігання - 6 місяців з дня виготовлення.
(Етавдіовая) - двухосновная гранична карбонова кислота, яка представляє собою хімічну речовину у вигляді безбарвних кристалів, розчинних у воді, неповністю - в діетиловому і етиловому спирті, нерозчинні в бензолі, хлороформі, петролейном ефірі. Ефіри й солі такої кислоти називаються оксалатами. Даний хімічний реактив відноситься до сильних органічних кислот, температура плавлення якого становить -189,5 ° C. У природі у вільному вигляді ця хімічна сполука, а також у вигляді оксалатів (ефіри і солі щавлевої кислоти) калію і кальцію міститься в багатьох рослинах: ревінь, боби, шпинат, горіхи, соя. Дана кислота утворюється при щавлевокислий бродінні. Вперше даний вид кислоти був одержаний в процесі синтезу диціану хіміком Фрідріхом Велером (Німеччина, 1824 рік).
Застосування щавлевої кислоти
Як і будь-яка кислота, щавлева завдяки своїм унікальним властивостям застосовується в наступних галузях промисловості:
- хімічної (при виготовленні пластмас, барвників, чорнила, піротехніки);
- металургійної (для чищення металів від корозії, оксидів, накипу, іржі);
- текстильної та шкіряної (як протрава, при фарбуванні шовку і вовни);
- бджільництво (для обробки бджіл);
- побутової хімії (входить до складу багатьох миючих засобів та порошків в якості відбілюючого і дезинфікуючий засіб);
- аналітичної хімії (осадитель рідкоземельних елементів);
- мікроскопії (відбілювач зрізів);
- косметології (відбілюючий компонент від веснянок);
- медицині і фармакології;
- деревообробної.
Важливість щавлевої кислоти для організму
Дане хімічна сполука в організмі людини - це проміжний продукт, який виділяється з сечею як солі кальцію. При порушенні мінерального обміну солі даної кислоти беруть участь в утворенні каменів в сечовому міхурі і нирках. Дана органічна кислота, що міститься в сирих овочах, дуже корисна для нашого організму. Вона легко з'єднується з кальцієм і сприяє його засвоєнню. Щавлева кислота в відварних овочах негативно позначається на здоров'ї, так як вона стає неорганічної. Це призводить до зв'язування кальцію, а як результат - до нестачі його в кістковій тканині, що є причиною її поразки. Добове виділення щавлевої кислоти разом з сечею у дорослої людини становить 20 мг, у дітей до 1, 29 мг / кг.
Запобіжні заходи
 Щавлева кислота відноситься до горючих, високотоксичних і отруйним хімічних реактивів, тому для роботи з нею допускаються тільки ті співробітники лабораторії, які пройшли спеціальний інструктаж з дотримання заходів безпеки:
Щавлева кислота відноситься до горючих, високотоксичних і отруйним хімічних реактивів, тому для роботи з нею допускаються тільки ті співробітники лабораторії, які пройшли спеціальний інструктаж з дотримання заходів безпеки:
- роботи проводити в спеціальній лабораторному посуді зі скла. Якщо лабораторний посуд буде з іншого матеріалу, кислота може вступити з нею в реакцію;
- щоб уникнути попадання щавлевої кислоти на шкіру, дихальні шляхи, слизові оболонки все дослідження слід проводити: в гумотехнічних виробах (чоботи, прогумовані фартухи, рукавички оглядові, рукавички нітрилові), захисних засобах (протигаз або респіратор, окуляри), спецодяг;
- під час використання щавлевої кислоти забороняється приймати їжу, пити, палити;
- після завершення робіт необхідно особа і руки ретельно промити теплою водою з милом або нейтралізуючим засобом (розчином питної соди);
- забороняється транспортування і зберігання щавлевої кислоти спільно з харчовими продуктами;
- дотримуватися заходів протипожежної безпеки, якщо є необхідність у використанні нагрівальних приладів.
Потрібно знати, що щавлева кислота належить до сильних органічних кислот, вживання її у великій кількості може стати причиною подразнення слизової стравоходу, кишечника, шлунку, шкіри та дихальних шляхів. При попаданні даного хімічного реактиву в організм може з'явитися печіння, кривава блювота. Перша допомога в таких ситуаціях - рясно промити водою уражену ділянку шкіри. Зберігати кислоту потрібно в закритій поліетиленовій упаковці в добре вентильованому приміщенні на піддонах.
Щавлеву кислоту купити
Щавлеву кислоту купити, борну кислоту купити, лимонну кислоту купити, молочну кислоту купити, як і будь-який інший хімічний реактив, можна в магазині хімічних реактивів Москва роздріб і опт «Прайм Кемикалс Груп». На нашому сайті є все, що потрібно сучасній науковій або виробничої лабораторії. Купуючи будь-який товар в нашому інтернет-магазині, ви купуєте товар c сертифікатом якості, що відповідає всім стандартам ГОСТ за доступними цінами і виключаєте можливість покупки підробки.
"Prime Chemicals Group" - гарантія якості пропонованої продукції.
Щавлеву кислоту купити з доставкою по місту та області можна вигідно!
Щавлева кислота (етандіовая) - двохосновний карбонове з'єднання, що належить до класу сильних органічних кислот.
 Речовина широко поширене в природі, зустрічається у вигляді солей, ефірів, амідів, вільних ізомерів. Головні джерела щавлевої кислоти - свіжі ревінь, шпинат, щавель, листової буряк. Дані продукти «постачають» в організм і, необхідні для кровотворення, а також стимулюють роботу кишечника.
Речовина широко поширене в природі, зустрічається у вигляді солей, ефірів, амідів, вільних ізомерів. Головні джерела щавлевої кислоти - свіжі ревінь, шпинат, щавель, листової буряк. Дані продукти «постачають» в організм і, необхідні для кровотворення, а також стимулюють роботу кишечника.
Вперше етандіовая кислота синтезована з диціану в 1824 році німецьким біохіміком Фрідріхом Велером. У промислових масштабах її отримують шляхом окислення цукру азотною кислотою в присутності каталізатора реакції пятиокиси ванадію. У вигляді оксалату кальцію сполука міститься у всіх рослинах.
Вплив на людський організм
Щавлева кислота бере участь в метаболізмі есенціальних, а також має бактерицидну дію на травний тракт.
Добова потреба в речовині становить 20 - 30 міліграм. Верхній допустимий рівень споживання кислоти - 50 міліграм, перевищення даного порогу веде до розвитку симптомів передозування в організмі.
![]() Карбонове з'єднання застосовують при наступних патологіях:
Карбонове з'єднання застосовують при наступних патологіях:
- безплідді;
- головних болях (мігрені);
- атипичном клімаксі;
- аменорее;
- глистовихінвазіях;
- кровотечах;
- хронічному туберкульозі;
- імпотенції;
- синуситах, гайморитах;
- млявому кишечнику;
- ревматичних болях;
- хворобливих місячних з рясною кровотечею;
- трихомоніазі, хламідіозі;
- кишкових інфекціях (золотистий стафілокок, кишкова паличка, холера, черевний тиф).
Пам'ятайте, надмірне споживання щавлевої їжі веде до порушення абсорбції кальцію. Внаслідок чого, в сечостатевих органах формуються оксалатних каменів. При цьому, шкідливі кристали, «йдуть» за сечовим протоках, травмуючи слизову оболонку і забарвлюючись кров'яним пігментом в чорний колір. В результаті у людини з'являються гострі болі в черевній порожнині, паху і спині, утруднюється сечовипускання, змінюється колір урини.
Прийом великих порцій кислоти, крім каменеутворення, викликає такі проблеми:
- слабкість;
- нудоту;
- розлад шлунку;
- запаморочення;
- печіння носових пазух, ротової порожнини, горла;
- різі в животі.
У важких випадках утруднюється дихання і з'являється біль в загрудинної області.
Крім того, затримка етандіовой кислоти в організмі може бути наслідком нервових розладів. Для стабілізації кислотно ̶ лужної рівноваги, крім зниження споживання щавлевої продуктів, приймають заспокійливі комплекси. Якщо самостійно купірувати симптоми надлишку не вдалося, потрібно негайно звернутися до гастроентеролога.
застосування
 Завдяки бактерицидним і відбілюючим властивостям, щавлева кислота з успіхом використовується в наступних галузях промисловості:
Завдяки бактерицидним і відбілюючим властивостям, щавлева кислота з успіхом використовується в наступних галузях промисловості:
- металургійної (для очищення металів від накипу, корозії, іржі, оксидів);
- хімічної (при виготовленні барвників, пластмас, чорнила, піротехніки);
- текстильної (як протрава при фарбуванні вовни і шовку);
- мікроскопії (для відбілювання зрізів);
- сільському господарстві (як інсектицид);
- фармакології;
- деревообробної;
- косметології (в складі відбілюючих кремів, масок і сироваток);
- аналітичної хімії (для осадження рідкісноземельних елементів);
- побутової хімії (як відбілюючий і дезинфікуючий компонент миючих засобів).
Крім цього, речовина використовують при створенні харчових добавок і біологічно - активних комплексів (як консервант).
Запобіжні заходи
Щавлева кислота, яка використовується в промисловості, відноситься до високотоксичних реактивів третього класу небезпеки. Тому, при роботі з нею важливо дотримуватися техніки безпеки.
![]() Запобіжні заходи:
Запобіжні заходи:
- Будь-які дослідження виконувати в гумотехнічної одязі (чоботях, рукавичках, фартуху) і захисних засобах (респіраторі або протигазі, окулярах). Дотримання цієї вимоги допоможе уникнути потрапляння етандіовой кислоти на шкіру, слизові оболонки особи, в дихальні шляхи.
- Роботи проводити в скляному посуді. Якщо лабораторний інвентар виконаний з іншого матеріалу, кислота може вступити з ним в реакцію.
- У процесі використання речовини категорично заборонено пити, курити, приймати їжу.
- Після закінчення роботи з з'єднанням, обличчя і руки ретельно вимити водою з милом.
- Спільна транспортування кислоти і продуктів харчування категорично заборонена.
- При потребі використання нагрівальних приладів дотримуватися техніки пожежної безпеки.
- Зберігати з'єднання в закритій поліетиленовій тарі на піддонах в вентильованому приміщенні.
При попаданні технічної кислоти на шкіру уражену покрив рясно промивають водою, а при необхідності звертаються за медичною допомогою.
природні джерела
Джерелом етандіовой кислоти є продукти рослинного походження: концентрація речовини в листі рослин значно вище, ніж в стеблах і коренях.
| Найменування продукту | Зміст карбонового речовини на 100 грам їжі, міліграм |
|---|---|
| щавель | 700 — 850 |
| ревінь | 850 |
| шпинат | 600 – 750 |
| Буряк листовий (мангольд) | 500 — 670 |
| спаржа | 640 |
| боби какао | 550 — 600 |
| буряк | 500 |
| Зерна пшениці пророщені | 270 |
| арахіс обсмажений | 180 |
| Чорний шоколад | 110 |
| петрушка | 100 |
| Шкірка лимона, лайма | 90 |
| Зелена цибуля | 85 |
| Виноград | 26 |
| селера | 20 |
| Червона смородина | 19 |
| баклажани | 18 |
| Полуниця | 16 |
| Горошок зелений (свіжий) | 15 |
| малина | 14 |
| Пастернак посівний | 11 |
| Зливи | 10 |
| чорнослив | 6 |
| Спаржева квасоля | 5,5 |
| персики | 5 |
| Чорна смородина | 4,5 |
| Білий хліб | 4,5 |
| Чорний чай | 4,5 |
| апельсини | 4 |
| морква | 4 |
| Яблука, груші | 3 |
| томати | 2 |
| вишня | 1,5 |
| огірки | 1 |
Щавлева кислота в малих кількостях (0,3 - 2 мг) присутня у всіх молочних, м'ясних і рибних виробах.
Цікаво, що в процесі термічної обробки продуктів, речовина переходить в неорганічну форму, утворюючи з кальцієм важкорозчинні солі (оксалати). Регулярне споживання такої їжі, крім каменеутворення, призводить до порушення засвоєння кальцію, і як наслідок, руйнування кісткової і хрящової тканин.
Етандіовая кислота - ефективний засіб боротьби з кліщовим ураженням бджіл (варроатозом, акарапидозом).
Усувають інвазію шляхом мелкодісперстних обприскування комах щавлевим розчином. Для цього 20 грам технічної кислоти розчиняють в літрі теплої нежорсткої води (виходить двохвідсотковий водний інсектицид). Склад готують безпосередньо перед застосуванням.
Для ущільнення бджіл, з вулика прибирають пергові і полномедовие стільники. Після цього, по черзі виймають рамки з комахами, обприскуючи їх з обох сторін. На обробку однієї конструкції витрачається 10 - 12 мілілітрів розчину.
У разі використання парів щавлевої кислоти в вулику зачиняють верхню камеру, а в нижню вводять 10 - 14 клубів диму. Потім в робочий відсік засипають 2 грами речовини (на кожні 10 - 15 обсиджені рамок), прогріваючи паяльною лампою вихідну трубу (5 - 6 секунд). Після цього нагрівач вводять у вічко на 30 - 40 секунд, чекаючи появи смогу з «димаря» доказ. Після закінчення протруювання, в камеру нагнітають повітря за допомогою автомобільного насоса (4 - 7 повних качків).
Обробку щавлевим з'єднанням проводять 2 - 5 разів на рік. Водний розчин доцільно використовувати при температурі навколишнього середовища не нижче 16 градусів, а пари кислоти не менше 10 градусів. Первинну обробку вуликів проводять ранньою весною, після масового обльоту бджіл. При сильній інвазії процедуру повторюють через 7 - 12 днів. Вторинну обробку бджіл виробляють влітку, після відкачування товарного меду і до початку підгодівлі комах. У разі виникнення потреби осіннього протруювання, процедуру проводять після виходу «трудівниць» з розплоду.
висновок
Отже, щавлева кислота - натуральне з'єднання, яке входить до складу продуктів рослинного походження. Речовина сприяє правильному кровотворенню, прискоренню обміну речовин, «дезінфекції» травного тракту. Головні джерела етандіовой кислоти - щавель, шпинат, ревінь, мангольд. Оптимальний рівень споживання елемента - 20 - 30 міліграм добу. Однак, важливо враховувати, що надлишок кислоти в організмі може призвести до освітою оксалатних каменів в сечостатевих органах. Тому людям з хворобами нирок, ревматоїдний артрит, сечокислим діабетом і подагрою доцільно обмежити споживання даної речовини.