Оксалова киселина
Федерална агенция за образование
Държавна образователна институция за висше професионално образование
ДЪРЖАВЕН ТЕХНИЧЕСКИ УНИВЕРСИТЕТ ВОЛГОГРАД
(VSTU)
Катедра "Технология на високо молекулно тегло и влакнести материали"
Семестър работа
дисциплина "Основи на химичните процеси"
Тема: „Характеризиране на процесите, възникващи при синтеза на оксалова киселина. Изчисляване на материалния и топлинния баланс. "
Волгоград 2011г
Химични свойства.
Физични свойства.
Методи за получаване.
приложение
Пазар на продажби
GOST за продажба
Материален баланс
Топлинен баланс
Химични свойства:
Оксалова киселина (етандиоева киселина) C2H2O4 е двуосновна наситена карбоксилна киселина. Принадлежи към силни органични киселини. Той има всички химични свойства, характерни за карбоксилните киселини. Солите и естерите на оксаловата киселина се наричат \u200b\u200bоксалати. Той се намира в природата в киселец и някои други растения под формата на калиеви и калциеви оксалати.
Оксаловата киселина е синтезирана за първи път през 1842 г. от немски химик Фридрих Вьолер от Тизиан. Оксаловата киселина (или оксалатният йон С2О4 2-) е редуциращ агент (обезцветява разтвора на KMnO4).
Оксаловата киселина е лесно разтворима във вода и алкохол. Това е сравнително силна органична киселина (клас на опасност 3), NOOS-COOH, е безцветни хигроскопични кристали, лесно разтворими във вода, ограничено в етилов алкохол и диетилов етер, неразтворими в хлороформ, петролен етер и бензен. Образува дихидрат от състав C 2 H 2 O 4 * 2H 2 O. Горющо вещество, в успокоено състояние, опасност от пожар. Има силно дразнещо действие върху кожата, лигавиците на очите и горните дихателни пътища.
Оксаловата киселина има химичните свойства, характерни за карбоксилните киселини, образувайки два реда производни. Солите и естерите на оксаловата киселина се наричат \u200b\u200bоксалати. Оксаловата киселина образува киселинни и средни естери, амиди, киселинен хлорид.
Оксаловата киселина се намира в киселец и ревен като калиев оксалат.

Тази киселина е много разпространена в растителния свят - под формата на соли се намира в листата на киселец, киселина, ревен и др. Солите и естерите на тази киселина имат тривиално наименование - оксалати (от гръцки. "Oxalis" - киселец).
проявява общите свойства на киселините. тъй като има функционална карбоксилна група. Реакцията на образуване на сол доказва киселинните свойства на мравчената киселина. В този случай се образуват соли - формати.
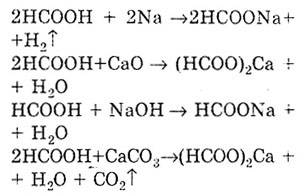
Както всички карбоксилни киселини, мравчената киселина образува естери.
Реакцията на естерификация:
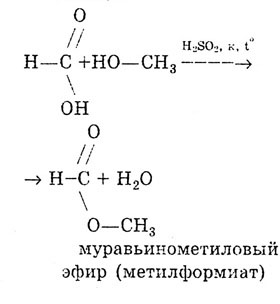
Мравчената киселина се различава от другите карбоксилни киселини по това, че карбоксилната група в нея не е свързана с въглеводороден радикал, а с водороден атом. Следователно мравчената киселина може да се разглежда и като киселина, и като алдехид:

Подобно на алдехидите, мравчената киселина може да окисли:
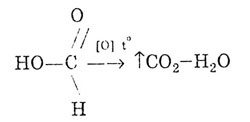
Мравчената киселина дава реакцията на "сребърното огледало":
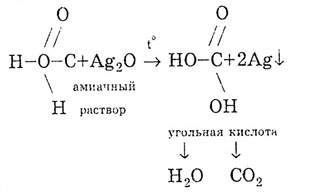
Мравчена киселина се разлага при нагряване:
![]()
мравчена киселина принадлежи към хомоложната серия от моноосновни карбоксилни киселини
Физични свойства:
Температура на сублимация: вижте бележки ° C
Точка на топене: 102 ° C
Относителна плътност (вода \u003d 1): 1.7
Разтворимост във вода, g / 100 ml: 10
Парно налягане, Pa при 30 ° C: виж бележки
Относителна плътност на парите (въздух \u003d 1): 3.1
Оксаловата киселина е една от най-силните карбоксилни киселини, далеч превъзхождаща силата си спрямо своите хомолози.
Етановата киселина проявява редуциращи свойства: в подкиселен разтвор на калиев перманганат се окислява до въглероден оксид (IV) и вода.
При нагряване в присъствието на сярна киселина се получава декарбоксилиране и се получават въглероден оксид (IV) и мравчена киселина.
Точките на кипене на мастните киселини с нормална структура естествено се увеличават с увеличаването на броя на въглеродните атоми. Установено е, че молекулите на киселината са свързани по същия начин, както молекулите вода или алкохол са свързани. По-ниските киселини са добре дестилирани с водна пара, поради което обикновено се наричат \u200b\u200bлетливи мастни киселини.
Точките на топене на моноосновните киселини с увеличаване на броя на въглеродните атоми в техните молекули също обикновено се увеличават; но в същото време се наблюдава следната закономерност: киселини с нормална верига с четен брой въглеродни атоми обикновено се стопяват при по-висока температура от предишните и следващите членове на хомоложната серия с нечетен брой въглеродни атоми.
ХИМИЧНИ ОПАСНОСТИ:
Веществото се разлага при бързо нагряване над около 150 ° C, за да се получи токсичен газ. Воден разтвор е киселина със средна сила, която реагира бурно със силни основи. Реагира бурно с окислители, което води до пожар и експлозия. Реагира със сребро за получаване на експлозивни продукти.
На подаване на заявлението.
Оксаловата киселина и нейните соли се използват в текстилната и кожената промишленост като мочалка; като компонент на анодни вани за отлагане на покрития от Al, Ti и Sn; като реагент в аналитичната и органичната химия; компонент на състави за почистване на метали от ръжда и оксиди; за отлагане на редки земи. Оксамид е стабилизатор на целулозните нитрати, цианът е реагент в органичния синтез, оксалил хлоридът е реагент за хлориране, хлорокарбонилиране и омрежване в органичен синтез. Като целулозни разтворители се използват диалкилаксалати, главно диетил оксалат и дибутил оксалат; някои естери на оксалова киселина и заместени феноли - като хемилуминесцентни реагенти.
Оксаловата киселина се използва за полиране на метали, в дървообработващата промишленост, при пречистване на уран
Области на приложение на оксалова киселина и нейните соли (оксалати):
в химическата промишленост (органичен синтез, в производството на пластмаси, мастила, в синтеза на багрила, като компонент на пиротехническите състави);
в химическата металургия (като компонент на съставите за почистване на метали от ръжда, котлен камък, оксиди);
в аналитичната химия (като утайка на редкоземните елементи);
в микроскопия (като белина на секции);
в текстилната и кожената промишленост (мариноване при сито печат и боядисване на вълна и коприна при дъбене на кожа);
в производството на синтетични детергенти (като избелващ и дезинфектант, средство за почистване и отстраняване на камъни в урината, соли на твърдост и ръжда);
в козметиката (като активна добавка при избелващи кремове и кремове от лунички);
в системи за пречистване на вода (химичен метод за пречистване и намаляване на твърдостта на водата, пречистване на охлаждащите течности в атомните електроцентрали);
в медицината и фармацевтиката.
Методи за получаване:
1) Като страничен продукт при производството на оцетна киселина чрез окисляване на бутан в течна фаза.
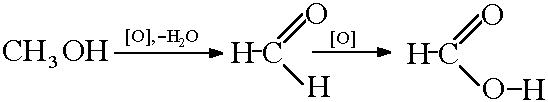
2) Окисляване на метанол:
Реакцията на въглероден оксид с натриев хидроксид:
NaOH + CO → HCOONa → (+ H3SO4, −Na2SO4) HCOOH
Това е основният промишлен метод, който се провежда на два етапа: на първия етап въглеродният окис под налягане от 0,6-0,8 МРа се пропуска през натриев хидроксид, нагрят до 120-130 ° С; във втория етап натриевият формат се обработва със сярна киселина и продуктът се дестилира във вакуум.
Разлагането на глицеролови естери на оксалова киселина. За да направите това, безводен глицерин с оксалова киселина се нагрява, а водата се дестилира и се образуват оксалови естери. С по-нататъшното нагряване естерите се разлагат, отделяйки въглероден диоксид и се образуват мравчени естери, които след разлагане с вода дават мравчена киселина и глицерин.
Ограничаващата карбоксилна двуосновна киселина с груба формула C2H2O4 се нарича, според системната номенклатура, етандиоева киселина. Това вещество е известно и под друго, по-разпространено име - оксалова киселина. За първи път е получен от немския химик Ф. Уелър от тизиан (динитрил на оксалова киселина) през 1824г. Безцветните киселинни кристали се разтварят във вода и образуват безцветни разтвори. Моларната маса е 90,04 g / mol. На външен вид прилича на моноклинни безцветни кристали. При температура 20 ° С 8 g оксалова киселина се разтварят в 100 g вода. Добре разтворим е в ацетон, етилов алкохол и серен етер. Плътност 1,36 g / cm³. Топи се при температура 189,5 ° C, сублимира при 125 ° C, разлага се при 100-130 ° C.
Оксаловата киселина има всички химични свойства, характерни за карбоксилните киселини. Формулата му: NOOS - UNO. Въпреки факта, че принадлежи към карбоксилни киселини, тя се счита за силна органична киселина (3 000 пъти по-силна от оцетната киселина): C2O4H2 → C2O4H- + H + (pK \u003d 1,27) и по-нататък: C2O4H- → C2O42 - + H + (pK \u003d 4.27). Естерите и солите на тази киселина се наричат \u200b\u200bоксалати. Оксалатният йон С2О42− е редуциращ агент. Когато оксаловата киселина реагира с (KMnO4), последната се намалява и разтворът се обезцветява. Характеризира се с обратима и бавно протичаща реакция на взаимодействие с алкохоли (естерификация), в резултат на което се образуват естери: HOOC - COOH + 2HOR ↔ 2H2O + ROOC - COOR.
В промишлеността оксаловата киселина се получава чрез окисляване на химичните съединения. Например, в присъствието на ванадиев катализатор (V2O5), смес от азотна (HNO3) и сярна (H2SO4) киселина окислява алкохоли, въглехидрати и гликоли. Използва се също метод за окисляване на етилен и ацетилен (HNO3) в присъствието на паладиеви соли на Pd (NO3) 2 или PdCl2. Оксаловата киселина се получава от пропилен, който се окислява с течен азотен диоксид (NO2). Има добра перспектива за метод за получаване на киселина чрез взаимодействие на натриев хидроксид (NaOH) с въглероден оксид (СО) през междинен етап от образуването на NaOH + CO → HCOONa. Тогава се образува натриев оксалат и се отделя водород: HCOONa + NaOH → NaOOC - COONa + H2. Оксаловата киселина се получава от натриев оксалат в кисела среда: NaOOC - COONa + 2H + → HOOC - COOH + 2Na +.
Оксалова киселина и оксалати присъстват в много растения, включително черен чай, открит при животни. Основната вреда за хората е свързана с бъбречна недостатъчност, която възниква поради взаимодействието на оксалова киселина с калций, което води до отлагането на твърдо вещество (CaC2O4) - основният компонент на камъните в бъбреците. Киселината провокира болка в ставите поради отлагането на подобни съединения в тях. Оксаловата киселина може да се образува в организма в резултат на метаболизма на етилен гликол от околната среда (например, средство против обледеняване за лечение на писти и самолети на летищата, както и от други създадени от човека източници). Потенциалните проблеми с оксалатите в човешкото тяло могат да бъдат разделени на две. Първо, важна макроклетка, калция се свързва с оксалова киселина и нейният дефицит се образува в клетките на тъканите и органите. Второто е образуването на камъни в бъбреците. Най-голямо количество оксалова киселина се намира в спанака, листата и стъблата на ревен, киселец, цвекло, магданоз и зелен лук.
- е безцветни моноклинични хигроскопични кристали, лесно разтворими във вода, ограничено в етилов алкохол и диетилов етер, неразтворими в хлороформ, петролев етер и бензен.Оксаловата киселина е двуосновна ограничаваща карбоксилна киселина. Принадлежи към силни органични киселини. Той има всички химични свойства, характерни за карбоксилните киселини. Солите и естерите на оксаловата киселина се наричат \u200b\u200bоксалати. Оксаловата киселина образува киселинни и средни естери, амиди, киселинен хлорид.
В природата се среща в киселец, ревен и някои други растения в свободна форма и под формата на калиеви и калциеви оксалати.
Плътност 1,36 g / cm³. Точка на топене - 189.5 ° C, температура на сублимация - 125 ° C, температура на разлагане - 100-130 ° C, температура на декарбоксилиране - 166-180 ° C.
Химична формула: C 2 H 2 O 4
 Използването на оксалова киселина.
Използването на оксалова киселина.
- в химическата промишленост (органичен синтез, производство на пластмаси, мастила, синтез на багрила, като компонент на пиротехнически състави);
- в химическата металургия (като компонент на съставите за почистване на метали от ръжда, котлен камък, оксиди) - в аналитичната химия (като утайка на редкоземните елементи);
- в микроскопия (като избелване на секции);
- в текстилната и кожената промишленост (мариноване при сито печат и боядисване на вълна и коприна при дъбене на кожа);
- при производството на синтетични детергенти (като избелващ и дезинфектант, средство за почистване и отстраняване на пикочния камък, соли на твърдост и ръжда);
- в козметиката (като активна добавка при избелващи кремове и кремове от лунички);
- в системи за пречистване на вода (химичен метод за пречистване и намаляване на твърдостта на водата, почистване на охлаждащите течности в атомните електроцентрали);
- в медицината и фармацевтиката.
Изисквания за безопасност.
Оксаловата киселина е горимо вещество; в утаено състояние прахът с оксалова киселина е запалим; по степента на излагане на тялото принадлежи към вещества от втори клас на опасност.
Има силно дразнещо действие върху кожата, лигавиците на очите и горните дихателни пътища. Оксаловата киселина и нейните соли са токсични. Когато работите с оксалова киселина, трябва да се използва ЛПС.
Опаковка, транспорт и съхранение.
Техническата оксалова киселина е опакована в найлонови торбички или в торби, изработени от пластмасово фолио с цветен печат. Също така може да се опакова в шперплат барабани с вложка за филмова торба или меки специализирани контейнери за еднократна употреба.
Оксаловата киселина се транспортира от всички видове транспорт. Да се \u200b\u200bсъхранява в опаковката на производителя в затворени, проветриви складове на палети.
Гаранционен срок на съхранение - 6 месеца от датата на производство.
(етавдиоева) - двуосновна ограничаваща карбоксилна киселина, която е химическо вещество под формата на безцветни кристали, разтворимо във вода, непълно в диетилов и етилов алкохол, неразтворимо в бензен, хлороформ, петролен етер. Естерите и солите на такава киселина се наричат \u200b\u200bоксалати. Този химически реагент е силна органична киселина с точка на топене -189.5 ° C. В природата в своята свободна форма това химическо съединение, както и под формата на оксалати (естери и соли на оксалова киселина) от калий и калций, се среща в много растения: ревен, боб, спанак, ядки, соя. Тази киселина се образува по време на оксалова ферментация. За първи път този вид киселина е получена по време на синтеза на дизиан от химика Фридрих Вьолер (Германия, 1824).
Използването на оксалова киселина
Както всяка киселина, оксаловата, поради своите уникални свойства, се използва в следните индустрии:
- химически (при производството на пластмаси, багрила, мастила, пиротехника);
- металургични (за почистване на метали от корозия, оксиди, котлен камък, ръжда);
- текстил и кожа (като шпилка, при боядисване на коприна и вълна);
- пчеларство (за преработка на пчели);
- домакински химикали (включени в много почистващи препарати и прахове като избелващо и дезинфектантно средство);
- аналитична химия (рядкоземна утайка);
- микроскопия (бели секции);
- козметология (избелващ компонент от лунички);
- медицина и фармакология;
- дървообработване.
Значението на оксаловата киселина за тялото
Това химично съединение в човешкото тяло е междинен продукт, който се отделя с урината като калциеви соли. В случай на нарушаване на минералния метаболизъм, солите на тази киселина участват в образуването на камъни в пикочния мехур и бъбреците. Тази органична киселина, която се намира в суровите зеленчуци, е много полезна за нашето тяло. Лесно се комбинира с калций и допринася за усвояването му. Оксаловата киселина в варените зеленчуци се отразява негативно на здравето, тъй като става неорганична. Това води до свързването на калция и в резултат на това липсата му в костната тъкан, което е причината за увреждането му. Ежедневната екскреция на оксалова киселина с урина при възрастен е 20 mg, при деца до 1,29 mg / kg.
Предпазни мерки за безопасност
 Оксаловата киселина е горим, силно токсичен и токсичен химически реагент, поради което само тези лабораторни служители, които са преминали специално обучение за мерки за безопасност, могат да работят с нея:
Оксаловата киселина е горим, силно токсичен и токсичен химически реагент, поради което само тези лабораторни служители, които са преминали специално обучение за мерки за безопасност, могат да работят с нея:
- извършват работа в специална лабораторна стъклария. Ако лабораторната стъклена посуда е от друг материал, киселината може да реагира с нея;
- за да се избегне контакт на оксалова киселина върху кожата, дихателните пътища, лигавиците, трябва да се извършват всички изследвания: в гумени изделия (ботуши, гумирани престилки, ръкавици за изследване, нитрилови ръкавици), предпазни средства (противогаз или респиратор, очила), защитно облекло;
- по време на употребата на оксалова киселина е забранено да се яде, пие, пуши;
- след приключване на работата е необходимо да се изплакнат обилно лицето и ръцете с топла вода и сапун или неутрализиращо средство (разтвор на питейна сода);
- транспортирането и съхранението на оксалова киселина заедно с храната е забранено;
- спазвайте мерките за пожарна безопасност, ако е необходимо използването на отоплителни устройства.
Трябва да знаете, че оксаловата киселина е силна органична киселина, употребата й в големи количества може да предизвика дразнене на лигавицата на хранопровода, червата, стомаха, кожата и дихателните пътища. Ако този химически реагент навлезе в тялото, може да се появи усещане за парене, кърваво повръщане. Първа помощ в такива ситуации е да изплакнете обилно с вода върху засегнатата област на кожата. Съхранявайте киселина в затворена пластмасова торбичка в добре проветриво място на палети.
За да купите оксалова киселина
За закупуване на оксалова киселина, за закупуване на борна киселина, за закупуване на лимонена киселина, за закупуване на млечна киселина, както и за всеки друг химически реагент, е възможно в московския магазин за химически реагенти на дребно и на едро "Prime Chemicals Group". Нашият сайт разполага с всичко, от което се нуждае съвременна научна или производствена лаборатория. Когато купувате всеки продукт в нашия онлайн магазин, закупувате продукт със сертификат за качество, който отговаря на всички стандарти GOST на достъпни цени и изключва възможността за закупуване на фалшив.
„Prime Chemicals Group” - гаранция за качеството на предлаганите продукти.
Можете да закупите оксалова киселина с доставка в града и региона Благоприятно!
Оксалова киселина (етандиоева) е двуосновно карбоксилно съединение, принадлежащо към класа на силните органични киселини.
 Веществото е широко разпространено в природата, намира се под формата на соли, естери, амиди, свободни изомери. Основните източници на оксалова киселина са пресен ревен, спанак, киселец и листно цвекло. Тези продукти "доставят" в организма и са необходими за хематопоезата, а също така стимулират червата.
Веществото е широко разпространено в природата, намира се под формата на соли, естери, амиди, свободни изомери. Основните източници на оксалова киселина са пресен ревен, спанак, киселец и листно цвекло. Тези продукти "доставят" в организма и са необходими за хематопоезата, а също така стимулират червата.
За първи път етандиовата киселина е синтезирана от дициан през 1824 г. от немския биохимик Фридрих Велер. В индустриален мащаб се получава чрез окисляване на захарта с азотна киселина в присъствието на катализатор за реакцията на ванадиев пентоксид. Под формата на калциев оксалат съединението се намира във всички растения.
Ефекти върху човешкото тяло
Оксаловата киселина участва в метаболизма на есенциалната, а също така има бактерициден ефект върху храносмилателния тракт.
Дневната нужда от вещество е от 20 до 30 милиграма. Горното допустимо ниво на прием на киселина е 50 милиграма, превишаването на този праг води до развитие на симптоми на предозиране в организма.
![]() Въглеродното съединение се използва при следните патологии:
Въглеродното съединение се използва при следните патологии:
- безплодие;
- главоболие (мигрена);
- атипична менопауза;
- аменорея;
- хелминтни инвазии;
- кървене;
- хронична туберкулоза;
- импотентност;
- синузит, синузит;
- мудни черва;
- ревматични болки;
- болезнени периоди с обилно кървене;
- трихомониаза, хламидия;
- чревни инфекции (Staphylococcus aureus, Escherichia coli, холера, коремен тиф).
Не забравяйте, че прекомерната консумация на оксалова храна води до нарушаване на абсорбцията на калций. В резултат на това в пикочно-половите органи се образуват оксалатни камъни. В същото време вредните кристали "отиват" по пикочните канали, наранявайки лигавицата и оцветявайки с черен пигмент кръв. В резултат на това човек има остри болки в коремната кухина, слабините и гърба, уринирането е затруднено, цвета на урината се променя.
Приемът на големи порции киселина, в допълнение към образуването на камъни, причинява следните проблеми:
- слабост;
- гадене;
- стомашно разстройство;
- виене на свят;
- изгаряне на синусите, устата, гърлото;
- нарязани в стомаха.
В тежки случаи дишането е затруднено и болката се появява в гръдната кост.
Освен това, задържането на етандиоева киселина в организма може да се дължи на нервни разстройства. За стабилизиране на киселинно-алкалния баланс, освен намаляване на консумацията на оксалови продукти, се вземат седативни комплекси. Ако не можете сами да спрете симптомите на излишък, незабавно трябва да се консултирате с гастроентеролог.
приложение
 Благодарение на бактерицидните и избелващи свойства оксаловата киселина се използва успешно в следните индустрии:
Благодарение на бактерицидните и избелващи свойства оксаловата киселина се използва успешно в следните индустрии:
- металургични (за почистване на метали от мащаб, корозия, ръжда, оксиди);
- химически (при производството на багрила, пластмаси, мастила, пиротехника);
- текстил (като мочалка за боядисване на вълна и коприна);
- микроскопия (за избелващи участъци);
- земеделие (като инсектицид);
- фармакология;
- дървообработване;
- козметология (като част от избелващи кремове, маски и серуми);
- аналитична химия (за отлагане на редки земи);
- домакински химикали (като избелващ и дезинфекционен компонент на перилни препарати).
В допълнение, веществото се използва за създаване на хранителни добавки и биологично активни комплекси (като консервант).
Предпазни мерки за безопасност
Оксаловата киселина, използвана в промишлеността, е силно токсичен реагент от третия клас на опасност. Ето защо, когато работите с него, е важно да се спазват мерките за безопасност.
![]() предпазни мерки:
предпазни мерки:
- Извършете всякакви изследвания на гумено-техническо облекло (ботуши, ръкавици, престилка) и защитни средства (респиратор или противогаз, очила). Спазването на това изискване ще помогне да се избегне попадането на етандиоена киселина по кожата, лигавиците на лицето, в дихателните пътища.
- Работа, извършена в стъклена купа. Ако лабораторното оборудване е направено от друг материал, киселината може да реагира с него.
- В процеса на използване на веществото е строго забранено да се пие, пуши, да се яде храна.
- След като приключите работата със съединението, измийте добре лицето и ръцете си със сапун и вода.
- Съвместният транспорт на киселина и храна е строго забранен.
- Ако е необходимо, използвайте отоплителни уреди, за да спазвате правилата за пожарна безопасност.
- Съхранявайте съединението в затворен пластмасов контейнер върху палети на проветриво място.
Ако техническата киселина попадне върху кожата, засегнатото покритие се изплаква обилно с вода и при необходимост потърсете медицинска помощ.
Естествени извори
Съкровищата на етановата киселина са продукти от растителен произход: концентрацията на веществото в листата на растенията е много по-висока, отколкото в стъблата и корените.
| Име на продукта | Съдържанието на въглерод в 100 грама храна, милиграми |
|---|---|
| киселец | 700 — 850 |
| ревен | 850 |
| спанак | 600 – 750 |
| Лист на буряк (сирене) | 500 — 670 |
| аспержи | 640 |
| Какао боб | 550 — 600 |
| цвекло | 500 |
| Покълнали пшенични зърна | 270 |
| Печени фъстъци | 180 |
| Тъмен шоколад | 110 |
| магданоз | 100 |
| Корите на лимон, вар | 90 |
| праз-лук | 85 |
| грозде | 26 |
| целина | 20 |
| Червена касис | 19 |
| патладжан | 18 |
| ягоди | 16 |
| Зелен грах (пресен) | 15 |
| малина | 14 |
| Засяване на магданоз | 11 |
| сливи | 10 |
| сушени сливи | 6 |
| Аспержи боб | 5,5 |
| праскови | 5 |
| Касис | 4,5 |
| Бял хляб | 4,5 |
| Черен чай | 4,5 |
| портокали | 4 |
| моркови | 4 |
| Ябълки, круши | 3 |
| домати | 2 |
| череша | 1,5 |
| краставици | 1 |
Оксалова киселина в малки количества (0,3 - 2 милиграма) присъства във всички млечни, месни и рибни продукти.
Интересно е, че в процеса на топлинна обработка на продуктите веществото преминава в неорганична форма, образувайки трудноразтворими соли (оксалати) с калций. Редовната консумация на такава храна, в допълнение към образуването на камъни, води до нарушаване на абсорбцията на калций и в резултат на това - разрушаване на костите и хрущялите.
Етанодната киселина е ефективно средство за борба с уврежданията, пренасяни от кърлежи на пчелите (вароатоза, акарапидоза).
Елиминирайте инвазията чрез фино пръскане на насекоми с оксалов разтвор. За да направите това, 20 грама техническа киселина се разтварят в литър топла, не твърда вода (получава се дву процентен воден инсектицид). Съставът се приготвя непосредствено преди употреба.
За да запечатват пчелите, те изваждат от кошера пергови и пълнозърнести пчелни пити. След това изваждат рамки с насекоми, напръсквайки ги от двете страни. Обработката на един дизайн изразходва 10 до 12 милилитра разтвор.
В случай на използване на изпарения на оксалова киселина горната камера се затваря в кошера и в долната се вкарват 10-14 пуши дима. След това, 2 грама от веществото се изсипва в работното отделение (за всеки 10 - 15 нарушени рамки), като загрява изходната тръба с пулверизатор (5 - 6 секунди). След това нагревателят се вкарва в отвора за крана за 30 - 40 секунди, изчаквайки смога да се появи от показанията на пушача. След ецване въздухът се изпомпва в камерата с помощта на автомобилна помпа (4 до 7 пълни хода).
Обработката с оксалово съединение се извършва 2-5 пъти годишно. Препоръчително е да използвате воден разтвор при температура на околната среда най-малко 16 градуса, а киселинните пари най-малко 10 градуса. Основната обработка на кошерите се извършва в началото на пролетта, след масивна муха на пчели. При тежка инвазия процедурата се повтаря след 7 до 12 дни. Вторичната обработка на пчелите се извършва през лятото, след изпомпване на търговски мед и преди да се хранят насекомите. В случай на необходимост от есенна превръзка, процедурата се провежда след освобождаването на „тоалетите” от породата.
заключение
Така че, оксаловата киселина е естествено съединение, което е част от продукти на растителна основа. Веществото насърчава правилната хематопоеза, ускорява метаболизма, "дезинфекция" на храносмилателния тракт. Основните източници на етандиоева киселина са киселец, спанак, ревен, сирене. Оптималното ниво на консумация на елементи е 20-30 милиграма на ден. Важно е обаче да се има предвид, че излишната киселина в тялото е изпълнена с образуването на оксалатни камъни в урогениталните органи. Ето защо е препоръчително за хора с бъбречни заболявания, ревматоиден артрит, диабет на пикочна киселина и подагра да ограничат приема на това вещество.





