Oksalna kiselina
Federalna agencija za obrazovanje
Državna obrazovna ustanova visokog stručnog obrazovanja
VOLGOGRADSKI DRŽAVNI TEHNIČKI UNIVERZITET
(VolgSTU)
Odsjek "Tehnologija visokomolekularnih i vlaknastih materijala"
Semestralni rad
u disciplini "Osnove hemijskih procesa"
Tema: „Karakteristike procesa koji se javljaju tokom sinteze oksalne kiseline. Proračun bilansa materijala i topline ".
Volgograd 2011
Hemijska svojstva.
Fizička svojstva.
Metode dobijanja.
Aplikacija
Tržište prodaje
GOST na prodaju
Materijalni bilans
Toplotna ravnoteža
Hemijska svojstva:
Oksalna kiselina (etandioična kiselina) C 2 H 2 O 4 je dvobazna zasićena karboksilna kiselina. Pripada jakim organskim kiselinama. Poseduje sva hemijska svojstva karakteristična za karboksilne kiseline. Soli i esteri oksalne kiseline nazivaju se oksalati. U prirodi se nalazi u kiselici i nekim drugim biljkama u obliku kalijevih i kalcijevih oksalata.
Oksalnu kiselinu prvi put je sintetizovao 1842. njemački hemičar Friedrich Wöhler iz cijanogena. Oksalna kiselina (ili oksalatni ion C 2 O 4 2-) je redukcijsko sredstvo (obezbojuje otopinu KMnO4).
Oksalna kiselina je lako topljiva u vodi i alkoholu. Relativno je jaka organska kiselina (klasa opasnosti 3), HOOC-COOH, predstavlja bezbojne higroskopne kristale, lako topive u vodi, ograničene u etilni alkohol i dietil eter, nerastvorljiv u kloroformu, naftnom etru i benzenu. Formira dihidrat sastava C 2 H 2 O 4 * 2H 2 O. Zapaljiva tvar, u taloženom stanju je opasna požar. Ima snažno nadražujuće djelovanje na kožu, sluznicu očiju i gornje dišne puteve.
Oksalna kiselina ima hemijska svojstva karakteristično za karboksilne kiseline, tvoreći dvije serije derivata. Soli i esteri oksalne kiseline nazivaju se oksalati. Oksalna kiselina stvara kisele i srednje estere, amide, kiseli klorid.
Oksalna kiselina se nalazi u kiselici i rabarbari kao kalijum oksalat.

Ova kiselina je vrlo rasprostranjena u biljnom svijetu - nalazi se u obliku soli u lišću kiselice, kisele, rabarbare itd. Soli i esteri ove kiseline imaju trivijalno ime - oksalati (od grčkog "oxalis" - kiseljak).
eksponata opšta svojstva kiseline, dakle. kao i funkcionalna karboksilna grupa. Reakcija stvaranja soli dokazuje kisela svojstva mravlje kiseline. U tom slučaju nastaju soli - formati.
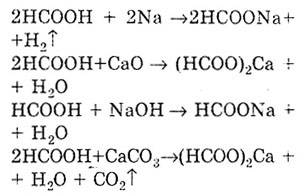
Kao i sve karboksilne kiseline, mravlja kiselina tvori estere.
Reakcija esterifikacije:
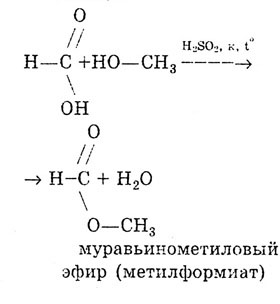
Mravlja se kiselina razlikuje od ostalih karboksilnih kiselina po tome što je karboksilna skupina u njoj povezana ne s ugljikovodičnim radikalom, već s atomom vodika. Stoga se mravlja kiselina može smatrati i kiselinom i aldehidom:

Kao i aldehidi, mravlja kiselina može se oksidirati:
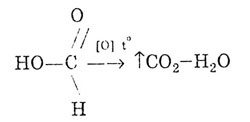
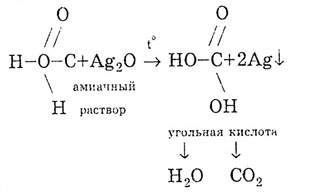
Mravlja kiselina daje reakciju srebrnog ogledala:
Mravlja kiselina se raspada pri zagrijavanju:
![]()
mravlja kiselina pripada homolognoj seriji jednobaznih karboksilnih kiselina
Fizička svojstva:
Temperatura sublimacije: vidi napomene ° C
Tačka topljenja: 102 ° C
Relativna gustoća (voda = 1): 1,7
Rastvorljivost u vodi, g / 100 ml: 10
Pritisak pare u Pa pri 30 ° C: vidi napomene
Relativna gustoća pare (zrak = 1): 3.1
Oksalna kiselina jedna je od najjačih karboksilnih kiselina, po snazi daleko superiornija od svojih homologa.
Etandiojska kiselina pokazuje redukcijska svojstva: u zakiseljenoj otopini kalijevog permanganata oksidira se u ugljikov monoksid (IV) i vodu.
Kada se zagrije u prisutnosti sumporne kiseline, dolazi do dekarboksilacije, te se dobiva ugljikov monoksid (IV) i mravlja kiselina.
Tačke ključanja masnih kiselina normalne strukture prirodno se povećavaju s povećanjem broja atoma ugljika. Utvrđeno je da su molekule kiseline povezane na isti način kao što su povezane molekule vode ili alkohola. Niže kiseline dobro se destiliraju vodenom parom, pa se obično nazivaju hlapljivim masnim kiselinama.
Tališta jednobaznih kiselina također se općenito povećavaju kako se povećava broj atoma ugljika u njihovim molekulama; međutim, primjećuje se sljedeća pravilnost: kiseline s normalnim lancem, koje imaju paran broj ugljikovih atoma, obično se tope na višoj temperaturi od prethodnog i sljedećih članova homolognog niza, koji imaju neparan broj ugljikovih atoma.
HEMIJSKE OPASNOSTI:
Tvar se raspada pri brzom zagrijavanju na oko 150 ° C stvarajući otrovni plin. Rastvor vode je kiselina srednje jačine koja burno reagira sa jakim bazama. Burno reagira s oksidansima uzrokujući opasnost od požara i eksplozije. Reaguje sa srebrom i stvara eksplozivne proizvode.
Aplikacija.
Oksalna kiselina i njene soli koriste se u tekstilnoj i kožarskoj industriji kao lužine; kao komponenta anodnih kupki za taloženje premaza Al, Ti i Sn; kao reagens u analitičkoj i organskoj hemiji; komponente sastava za čišćenje metala od hrđe i oksida; za taloženje elemenata rijetke zemlje. Oksamid je stabilizator celuloznih nitrata, cijan je reagens u organskoj sintezi, oksalil klorid je reagens za kloriranje, klorokarbonilaciju i umrežavanje u organskoj sintezi. Dialkil oksalati, uglavnom dietil oksalat i dibutil oksalat, koriste se kao otapala celuloze; neki esteri oksalne kiseline i supstituisanih fenola - kao hemiluminiscentni reagensi.
Oksalna kiselina se koristi za poliranje metala, u drvnoj industriji, za pročišćavanje urana
Područja primjene oksalne kiseline i njenih soli (oksalati):
u hemijskoj industriji (organska sinteza, u proizvodnji plastike, mastila, u sintezi boja, kao komponenta pirotehničkih sastava);
u hemijskoj metalurgiji (kao komponenta sastava za čišćenje metala od rđe, kamenca, oksida);
u analitička hemija(kao talog za elemente rijetke zemlje);
u mikroskopiji (kao sredstvo za izbjeljivanje kriški);
u industriji tekstila i kože (nagrizajuće u tisku silikona i pri bojenju vune i svile, pri štavljenju kože);
u proizvodnji sintetičkih deterdženata (kao izbjeljivač i dezinficijens, sredstvo za čišćenje i uklanjanje urinarnog kamenca, soli tvrdoće i hrđe);
u kozmetici (kao aktivni dodatak u kremama za izbjeljivanje i pjege);
u sistemima za prečišćavanje vode (hemijska metoda prečišćavanja i smanjenja tvrdoće vode, prečišćavanje rashladnih tečnosti u nuklearnim elektranama);
u medicini i farmaciji.
Načini dobijanja:
1) Kao nusprodukt u proizvodnji octene kiseline oksidacijom butana u tekućoj fazi.
2) Oksidacija metanola:
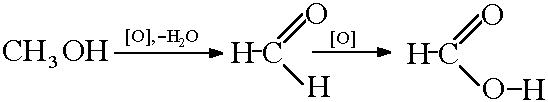
Reakcija ugljen monoksida sa natrijum hidroksidom:
NaOH + CO → HCOONa → ( + H3SO4, −Na2SO4) HCOOH
Ovo je glavna industrijska metoda koja se provodi u dvije faze: u prvoj fazi, ugljikov monoksid pod pritiskom od 0,6-0,8 MPa prolazi kroz natrij hidroksid zagrijan na 120-130 ° C; u drugoj fazi, natrijum formij se tretira sumpornom kiselinom i proizvod se destilira vakuumom.
Razlaganje estra glicerola oksalne kiseline. Za to se bezvodni glicerin zagrijava s oksalnom kiselinom, dok se voda destilira i nastaju oksalni estri. Nakon daljnjeg zagrijavanja, esteri se raspadaju oslobađajući ugljični dioksid i nastaju mravlji esteri koji nakon razgradnje s vodom daju mravlju kiselinu i glicerin.
Ograničavajuća karboksilna dvobazna kiselina bruto formule C2H2O4 naziva se, prema sistematskoj nomenklaturi, etandioična kiselina. Ova tvar je poznata i pod drugim, uobičajenijim imenom - oksalna kiselina. Prvi put ga je dobio njemački hemičar F. Wöhler iz cijanogena (dinitril oksalne kiseline) 1824. Bezbojni kristali kiseline rastvaraju se u vodi i formiraju bezbojne otopine. Molarna masa je 90,04 g / mol. By izgled podsjeća na monokliničke bezbojne kristale. Na temperaturi od 20 ° C, 8 g oksalne kiseline otopi se u 100 g vode. Dobro se otapa u acetonu, etilnom alkoholu i sumpornom etru. Gustoća 1,36 g / cm³. Topi se na temperaturi od 189,5 ° C, sublimira na 125 ° C, raspada se na 100-130 ° C.
Oksalna kiselina ima sva kemijska svojstva karakteristična za karboksilne kiseline. Njegova formula je: NOOS - COOH. Unatoč činjenici da pripada karboksilnim kiselinama, smatra se jakom organskom kiselinom (3000 puta jačom od octene kiseline): C2O4H2 → C2O4H- + H + (rK = 1,27) i dalje: C2O4H- → C2O42- + H + ( rK = 4,27). Estri i soli ove kiseline nazivaju se oksalati. Oksalatni ion C2O42− je redukcijsko sredstvo. Kada oksalna kiselina reagira s (KMnO4), ona se reducira i otopina postaje bezbojna. Karakteriše ga reverzibilna i sporo tekuća reakcija interakcije sa alkoholima (esterifikacija), usljed čega nastaju estri: HOOC - COOH + 2HOR ↔ 2H2O + ROOC - COOR.
U industriji se oksalna kiselina dobiva oksidacijom kemijskih spojeva. Na primjer, u prisutnosti vanadijevog katalizatora (V2O5), alkoholi, ugljikohidrati i glikoli oksidiraju se smjesom dušične (HNO3) i sumporne (H2SO4) kiseline. Također se koristi metoda oksidacije etilena i acetilena (HNO3) u prisutnosti paladijevih soli Pd (NO3) 2 ili PdCl2. Oksalna kiselina se dobiva iz propilena, koji se oksidira tekućim dušikovim dioksidom (NO2). Metoda proizvodnje kiseline interakcijom natrijevog hidroksida (NaOH) s ugljikovim monoksidom (CO) kroz srednju fazu stvaranja NaOH + CO → HCOONa ima dobre izglede. Tada nastaje natrijev oksalat i evoluira vodik: HCOONa + NaOH → NaOOC - COONa + H2. Oksalna kiselina se dobija iz natrijum oksalata u kiselom mediju: NaOOC - COONa + 2H + → HOOC - COOH + 2Na +.
Oksalna kiselina i oksalati prisutni su u mnogim biljkama, uključujući i crni čaj, a nalaze se i u životinjama. Glavna šteta za ljude povezana je s bubrežnom insuficijencijom, koja nastaje uslijed interakcije oksalne kiseline s kalcijem, što rezultira čvrstom taloženjem (CaC2O4) - glavnom komponentom bubrežnih kamenaca. Kiselina izaziva bol u zglobovima zbog taloženja takvih spojeva u njima. Oksalna kiselina može se formirati u tijelu kao rezultat metabolizma etilen glikola, koji dolazi iz okoliš(na primjer, sredstvo za odmrzavanje za piste i avione na aerodromima, kao i iz drugih antropogenih izvora). Potencijalni problemi s oksalatom kod ljudi mogu se podijeliti na dva. Prvo, važan makronutrijent kalcij veže oksalna kiselina i njegov nedostatak nastaje u stanicama tkiva i organa. Drugi je stvaranje bubrežnih kamenaca. Najveća količina oksalne kiseline nalazi se u špinatu, listovima i stabljikama rabarbare, kiseljaku, repu, peršinu i zelenom luku.
- predstavlja bezbojne monokliničke higroskopne kristale, lako topive u vodi, ograničene u etilnom alkoholu i dietil etru, nerastvorljive u kloroformu, naftnom etru i benzenu.Oksalna kiselina je dvobazna granica karboksilna kiselina... Pripada jakim organskim kiselinama. Poseduje sva hemijska svojstva karakteristična za karboksilne kiseline. Soli i esteri oksalne kiseline nazivaju se oksalati. Oksalna kiselina stvara kisele i srednje estere, amide, kiseli klorid.
U prirodi se nalazi u kiselici, rabarbari i nekim drugim biljkama u slobodnom obliku i u obliku kalijevih i kalcijevih oksalata.
Gustoća 1,36 g / cm³. Temperatura topljenja - 189,5 ° C, temperatura sublimacije - 125 ° C, temperatura razlaganja - 100-130 ° C, temperatura dekarboksilacije - 166-180 ° C.
Hemijska formula: C 2 H 2 O 4
 Upotreba oksalne kiseline.
Upotreba oksalne kiseline.
- u hemijskoj industriji (organska sinteza, u proizvodnji plastike, mastila, u sintezi boja, kao komponenta pirotehničkih sastava);
- u hemijskoj metalurgiji (kao komponenta sastava za čišćenje metala od rđe, kamenca, oksida) - u analitičkoj hemiji (kao taložnik rijetkih zemljanih elemenata);
- u mikroskopiji (kao sredstvo za izbjeljivanje kriški);
- u tekstilnoj i kožarskoj industriji (nagrizajući pri štampanju silikona i pri bojenju vune i svile, pri štavljenju kože);
- u proizvodnji sintetičkih deterdženata (kao izbjeljivač i dezinficijens, sredstvo za čišćenje i uklanjanje kamenca, soli tvrdoće i hrđe);
- u kozmetici (kao aktivni dodatak u kremama za izbjeljivanje i pjege);
- u sistemima za prečišćavanje vode (hemijska metoda prečišćavanja i smanjenja tvrdoće vode, prečišćavanje rashladnih tečnosti u nuklearnim elektranama);
- u medicini i farmaciji.
Sigurnosni zahtjevi.
Oksalna kiselina je zapaljiva tvar, u taloženom stanju prašina oksalne kiseline je opasna od požara, prema stupnju utjecaja na tijelo pripada tvarima druge klase opasnosti.
Ima snažno nadražujuće djelovanje na kožu, sluznicu očiju i gornje dišne puteve. Oksalna kiselina i njene soli su otrovne. Osobnu zaštitnu opremu treba koristiti pri radu s oksalnom kiselinom.
Pakovanje, transport i skladištenje.
Tehnička oksalna kiselina pakuje se u polietilenske vrećice ili u vrećice od polietilenske folije sa štampom u boji. Također se može pakirati u burad od šperploče s vrećicom od folije ili mekim specijaliziranim spremnicima za jednokratnu upotrebu.
Oksalna kiselina se transportira svim vrstama transporta. Skladištiti u ambalaži proizvođača u zatvorenim, ventiliranim skladištima na paletama.
Garantovani rok trajanja je 6 meseci od datuma proizvodnje.
(ethavdiic) je dvobazna zasićena karboksilna kiselina, koja je kemijska tvar u obliku bezbojnih kristala, topiva u vodi, nepotpuno u dietil i etilnom alkoholu, netopiva u benzenu, kloroformu, naftnom etru. Estri i soli takve kiseline nazivaju se oksalati. Ova kemikalija je jaka organska kiselina s talištem od -189,5 ° C. U prirodi se ovaj kemijski spoj u slobodnom obliku, kao i u obliku oksalata (estera i soli oksalne kiseline) kalija i kalcija nalazi u mnogim biljkama: rabarbara, pasulj, spanać, orasi, soja. Ova kiselina nastaje tijekom oksalne fermentacije. Prvi put je ovu vrstu kiseline dobio hemičar Friedrich Wöhler tokom sinteze cijanogena (Njemačka, 1824).
Upotreba oksalne kiseline
Kao i svaka kiselina, oksalna, zbog svoje jedinstvene nekretnine koristi se u sljedećim industrijama:
- kemijske (u proizvodnji plastike, bojila, tinte, pirotehnike);
- metalurški (za čišćenje metala od korozije, oksida, kamenca, hrđe);
- tekstil i koža (kao aditiv, pri bojenju svile i vune);
- pčelarstvo (za preradu pčela);
- hemikalije za domaćinstvo (uključene u mnoge deterdžente i praškove kao izbjeljivač i dezinficijens);
- analitička hemija (taložnik rijetkih zemljanih elemenata);
- mikroskopija (izbjeljivači kriški);
- kozmetologija (komponenta za izbjeljivanje pjega);
- medicina i farmakologija;
- obrada drveta.
Značaj oksalne kiseline za organizam
Ovaj kemijski spoj u ljudskom tijelu je međuprodukt koji se izlučuje urinom u obliku soli kalcija. Kršeći metabolizam minerala, soli ove kiseline učestvuju u stvaranju kamenaca u mjehuru i bubrezima. Ova organska kiselina sadržana u sirovo povrće, vrlo je koristan za naš organizam. Lako se kombinira s kalcijem i potiče njegovu apsorpciju. Oksalna kiselina u kuhanom povrću štetna je za zdravlje jer postaje anorganska. To dovodi do vezivanja kalcija, a kao posljedica - do njegovog nedostatka koštanog tkiva, što je razlog njenog poraza. Dnevno izlučivanje oksalne kiseline zajedno s urinom kod odraslih je 20 mg, kod djece do 1,29 mg / kg.
Mjere opreza
 Oksalna kiselina pripada zapaljivim, visoko toksičnim i otrovnim kemijskim reagensima, pa s njom smiju raditi samo oni djelatnici laboratorije koji su prošli posebna uputstva o poštivanju sigurnosnih mjera:
Oksalna kiselina pripada zapaljivim, visoko toksičnim i otrovnim kemijskim reagensima, pa s njom smiju raditi samo oni djelatnici laboratorije koji su prošli posebna uputstva o poštivanju sigurnosnih mjera:
- radovi koje treba izvesti u posebnom laboratorijskom staklenom posuđu. Ako je laboratorijsko stakleno posuđe izrađeno od drugog materijala, kiselina može reagirati s njim;
- kako bi se izbjegao prodor oksalne kiseline u kožu, respiratorni trakt, sluznicu, potrebno je provesti sve studije: u proizvodima od gume (čizme, gumirane pregače, rukavice za ispitivanje, rukavice od nitrila), zaštitnoj opremi (gas maska ili respirator , naočare), kombinezoni;
- za vrijeme upotrebe oksalne kiseline zabranjeno je jesti, piti, pušiti;
- nakon završetka posla potrebno je temeljito oprati lice i ruke toplom vodom i sapunom ili neutralizirajućim sredstvom (rastvor sode bikarbone);
- zabranjen je transport i skladištenje oksalne kiseline zajedno sa hrana;
- pridržavati se mjera zaštite od požara ako postoji potreba za korištenjem uređaja za grijanje.
Morate znati da oksalna kiselina pripada jakim organskim kiselinama, njena upotreba u veliki broj Može izazvati iritaciju sluznice jednjaka, crijeva, želuca, kože i respiratornog trakta. Ako ovaj kemijski reagens uđe u tijelo, može se pojaviti peckanje, krvavo povraćanje. Prva pomoć u takvim situacijama je ispiranje zahvaćene površine kože s puno vode. Skladištite kiselinu u zatvorenoj plastičnoj vrećici u dobro prozračenom prostoru na paletama.
Kupite oksalnu kiselinu
Kupite oksalnu kiselinu, kupite bornu kiselinu, limunska kiselina možete kupiti, kupiti mliječnu kiselinu, kao i svaki drugi kemijski reagens, u trgovini kemijskim reagensima u Moskvi na malo i veliko "Prime Chemicals Group". Naša web stranica ima sve što je potrebno modernoj naučnoj ili industrijskoj laboratoriji. Kupnjom bilo kojeg proizvoda u našoj internetskoj trgovini kupujete proizvod sa certifikatom kvalitete koji zadovoljava sve GOST standarde po pristupačnim cijenama i isključuje mogućnost kupnje lažnog.
“Prime Chemicals Group” garancija je kvalitete ponuđenih proizvoda.
Oksalnu kiselinu možete kupiti s dostavom u gradu i regiji Isplativo!
Oksalna kiselina (etandioična) je dvobazno karboksilno jedinjenje koje pripada klasi jakih organskih kiselina.
 Tvar je široko rasprostranjena u prirodi, javlja se u obliku soli, etera, amida, slobodnih izomera. Glavni izvori oksalne kiseline su svježa rabarbara, spanać, kiseljak i repa. Ovi proizvodi "opskrbljuju" tijelo i neophodni su za hematopoezu, kao i stimuliraju crijeva.
Tvar je široko rasprostranjena u prirodi, javlja se u obliku soli, etera, amida, slobodnih izomera. Glavni izvori oksalne kiseline su svježa rabarbara, spanać, kiseljak i repa. Ovi proizvodi "opskrbljuju" tijelo i neophodni su za hematopoezu, kao i stimuliraju crijeva.
Po prvi put etandioična kiselina je sintetizirana iz cijanogena 1824. godine od strane njemačkog biokemičara Friedricha Wöhlera. Proizvodi se u industrijskim razmjerima oksidacijom šećera. azotna kiselina u prisutnosti katalizatora za reakciju vanadijevog pentoksida. U obliku kalcijevog oksalata, spoj se nalazi u svim biljkama.
Uticaj na ljudsko telo
Oksalna kiselina je uključena u bitan metabolizam, a ima i baktericidno djelovanje na probavni trakt.
Dnevne potrebe za tvari su 20-30 miligrama. Gornji dopušteni nivo unosa kiseline je 50 miligrama, prekoračenje ovog praga dovodi do razvoja simptoma predoziranja u tijelu.
![]() Ugljikov spoj se koristi za sljedeće patologije:
Ugljikov spoj se koristi za sljedeće patologije:
- neplodnost;
- glavobolje (migrene);
- atipična menopauza;
- amenoreja;
- helmintičke invazije;
- krvarenje;
- hronična tuberkuloza;
- impotencija;
- sinusitis, sinusitis;
- troma crijeva;
- reumatski bolovi;
- bolne menstruacije s obilnim krvarenjem;
- trihomonijaza, klamidija;
- crijevne infekcije (Staphylococcus aureus, Escherichia coli, kolera, tifusna groznica).
Upamtite, pretjerana konzumacija oksalne hrane dovodi do smanjene apsorpcije kalcija. Kao rezultat toga, u genitourinarnim organima nastaju oksalatni kamenci. U isto vrijeme, štetni kristali "idu" duž mokraćnih kanala, ozlijeđujući sluznicu i crneći se pigmentom krvi. Kao rezultat toga, osoba ima oštri bolovi u trbušna šupljina, prepone i leđa, otežano mokrenje, promjene boje urina.
Uzimanje velikih količina kiseline, osim stvaranja kamenaca, uzrokuje sljedeće probleme:
- slabost;
- mučnina;
- stomačne tegobe;
- vrtoglavica;
- peckanje u sinusima, ustima, grlu;
- grčevi u abdomenu.
U teškim slučajevima disanje postaje otežano i pojavljuje se bol u prsima.
Osim toga, zadržavanje etandiojeve kiseline u tijelu može biti posljedica nervnih poremećaja. Za stabilizaciju acido-bazne ravnoteže, uz smanjenje potrošnje oksalnih proizvoda, uzimaju se i sedativni kompleksi. Ako nije bilo moguće samostalno zaustaviti simptome prekomjernosti, trebate se odmah obratiti gastroenterologu.
Aplikacija
 Zbog svojih baktericidnih svojstava i izbjeljivanja, oksalna kiselina se uspješno koristi u sljedećim industrijama:
Zbog svojih baktericidnih svojstava i izbjeljivanja, oksalna kiselina se uspješno koristi u sljedećim industrijama:
- metalurški (za čišćenje metala od kamenca, korozije, hrđe, oksida);
- kemijske (u proizvodnji boja, plastike, tinte, pirotehnike);
- tekstil (kao lužbina pri bojenju vune i svile);
- mikroskopija (za izbjeljivanje presjeka);
- poljoprivreda (kao insekticid);
- farmakologija;
- obrada drveta;
- kozmetologija (kao dio krema za izbjeljivanje, maski i seruma);
- analitička hemija (za taloženje rijetkih zemljanih elemenata);
- hemikalije za domaćinstvo (kao komponenta za izbjeljivanje i dezinfekciju deterdženata).
Osim toga, tvar se koristi za stvaranje aditivi za hranu i biološki aktivni kompleksi (kao konzervans).
Mjere opreza
Oksalna kiselina koja se koristi u industriji pripada visoko toksičnim reagensima treće klase opasnosti. Stoga je pri radu s njim važno poštivati sigurnosne mjere.
![]() Mjere opreza:
Mjere opreza:
- Sva istraživanja treba izvesti u gumenoj odjeći (čizme, rukavice, pregača) i zaštitnoj opremi (respirator ili gas maska, naočale). Poštivanje ovog zahtjeva pomoći će u izbjegavanju ulaska etandiojeve kiseline na kožu, sluznicu lica, u respiratorni trakt.
- Radove izvodite u staklenom posuđu. Ako je laboratorijska oprema izrađena od drugog materijala, kiselina može reagirati s njom.
- U procesu upotrebe tvari strogo je zabranjeno piti, pušiti, jesti.
- Nakon završetka rada sa smjesom, temeljito operite lice i ruke vodom i sapunom.
- Strogo je zabranjen zajednički transport kiseline i hrane.
- Ako je potrebno koristiti grijaće uređaje, pridržavajte se tehnika zaštite od požara.
- Skladištite smjesu u zatvorenoj plastičnoj posudi na paletama u ventiliranom prostoru.
Ako tehnička kiselina dospije na kožu, zahvaćena koža se obilno ispere vodom i po potrebi potražite liječničku pomoć.
Prirodni izvori
Skladište etandiojeve kiseline su proizvodi biljnog porijekla: koncentracija tvari u lišću biljaka mnogo je veća nego u stabljikama i korijenju.
| Ime proizvoda | Sadržaj ugljika na 100 grama hrane, miligrami |
|---|---|
| Kiseljak | 700 — 850 |
| Rabarbara | 850 |
| Spanać | 600 – 750 |
| Listna repa (blitva) | 500 — 670 |
| Šparoge | 640 |
| Zrna kakaovca | 550 — 600 |
| Cvekla | 500 |
| Proklijala zrna pšenice | 270 |
| Pečeni kikiriki | 180 |
| Tamna čokolada | 110 |
| Peršun | 100 |
| Kora limuna, limeta | 90 |
| Poriluk | 85 |
| Grejp | 26 |
| Celer | 20 |
| Red Ribes | 19 |
| Patlidžan | 18 |
| Jagoda | 16 |
| Zeleni grašak (svež) | 15 |
| Maline | 14 |
| Sjetva pastrnjaka | 11 |
| Šljive | 10 |
| Suhe šljive | 6 |
| Black Eyed Peas | 5,5 |
| Breskve | 5 |
| Crna ribizla | 4,5 |
| bijeli hljeb | 4,5 |
| Crni čaj | 4,5 |
| Narandže | 4 |
| Mrkva | 4 |
| Jabuke, kruške | 3 |
| Paradajz | 2 |
| Cherry | 1,5 |
| Krastavci | 1 |
Oksalna kiselina u malim količinama (0,3 - 2 miligrama) prisutna je u svim mliječnim, mesnim i ribljim proizvodima.
Zanimljivo, u procesu termičku obradu produkti, tvar se pretvara u anorganski oblik, tvoreći slabo topljive soli (oksalate) s kalcijem. Redovita konzumacija takve hrane, osim stvaranja kamenaca, dovodi i do oslabljene apsorpcije kalcija, a kao posljedica dolazi do uništavanja koštanog i hrskavog tkiva.
Etandioična kiselina - efikasan lek borba protiv krpelja zaraze pčela (varoatoza, akarapidoza).
Uklonite invaziju fino raspršenim prskanjem insekata oksalnom otopinom. Da biste to učinili, 20 grama tehničke kiseline otopi se u litri tople, tvrde vode (dobije se dvo postotni vodeni insekticid). Sastav se priprema neposredno prije upotrebe.
Da bi se zapečatile pčele, pčelinje saće i saće se uklanjaju iz košnice. Nakon toga se okviri s insektima vade jedan po jedan, prskajući ih s obje strane. Za preradu jedne strukture troši se 10 - 12 mililitara otopine.
U slučaju upotrebe para oksalne kiseline, gornja komora se zatvara u košnici, a u donju se unosi 10-14 dimova. Zatim se 2 grama tvari ulije u radni odjeljak (na svakih 10 - 15 rešetkastih okvira), zagrijavajući izlaznu cijev sa gorionikom (5 - 6 sekundi). Nakon toga, grijač se uvodi u otvor za vodu 30-40 sekundi, čekajući pojavu smoga iz dokaza "pušača". Nakon završetka jetkanja, zrak se upumpava u komoru pomoću automobilske pumpe (4 - 7 punih poteza).
Tretman oksalnim spojem provodi se 2 - 5 puta godišnje. Preporučljivo je koristiti vodeni rastvor na temperaturi okoline od najmanje 16 stepeni, a kisele pare najmanje 10 stepeni. Primarna obrada košnica vrši se u rano proljeće, nakon masovnog leta pčela. U slučaju teške invazije, postupak se ponavlja nakon 7 do 12 dana. Sekundarna obrada pčela vrši se ljeti, nakon ispumpavanja komercijalnog meda i prije hranjenja insekata. Ako postoji potreba za jesenskim prelivom, postupak se provodi nakon što "radnici" izađu iz legla.
Zaključak
Dakle, oksalna kiselina je prirodni spoj koji se nalazi u biljnim proizvodima. Tvar potiče pravilno stvaranje krvi, ubrzanje metabolizma, "dezinfekciju" probavnog trakta. Glavni izvori etandiojeve kiseline su kiselica, spanać, rabarbara i blitva. Optimalni nivo potrošnje elementa je 20 - 30 miligrama dnevno. Međutim, važno je uzeti u obzir da je višak kiseline u tijelu prepun stvaranja oksalatnih kamenaca u genitourinarnim organima. Stoga se preporučuje osobama s bubrežnom bolešću, reumatoidnim artritisom, dijabetesom mokraćne kiseline i gihtom da ograniče unos ove tvari.





